Teilen auf
Twitter Facebook LinkedIn WhatsAppDie Zahl der Autoimmunerkrankungen steigt. Mittlerweile leiden fünf bis acht Prozent aller Menschen in Deutschland unter einer Autoimmunerkrankung wie Diabetes Typ I, Morbus Crohn oder Schuppenflechte. Die Fallzahlen von Multipler Sklerose haben sich innerhalb der letzten 40 Jahre verdoppelt. Aber auch Asthma und Allergien sind auf dem Vormarsch. Fünf Prozent der deutschen Kinder und Jugendlichen erkranken vor ihrem 17. Lebensjahr an Asthma, bis zu sechs Prozent sind von Nahrungsmittelallergien betroffen.
Bei immer mehr Menschen scheint das Immunsystem fehlgeleitet zu sein und sich gegen den eigenen Körper oder harmlose Substanzen wie Pollen oder Nahrungsmittel zu richten. Ärzte vermuten genetische Ursachen, doch warum sollten sich unsere Gene nach Millionen Jahren der Evolution in wenigen Jahrzehnten derart stark verändert haben?
Möglicherweise gibt es eine andere Ursache: Studien zeigen, dass viele Betroffene einen Leaky Gut haben. Lassen sich Autoimmunkrankheiten und Allergien über den Darm beeinflussen und vielleicht sogar heilen?
Auslöser für Leaky Gut
Die Integrität der Darmschleimhaut hängt von verschiedenen äußeren und inneren Faktoren ab. Sie wird von einer gesunden Darmflora vor schädlichen Einflüssen aus dem Darminneren geschützt. Die Darmflora verliert ihre Barrierefunktion, wenn die protektive Säurerungsflora abnimmt und sich pathogene Keime und Pilze vermehren (Dybiose). Eine nährstoffarme “Western Diet” mit einem hohen Gehalt an Zusatzstoffen und industriell gefertigten Fetten fördern die Entstehung einer Dysbiose. Aber auch Stress, Umweltgifte, die Einnahme bestimmter Medikamente (insbesondere Antibiotika) sowie Drogenkonsum verändern die Zusammensetzung des Mikrobioms oder greifen die Darmschleimhaut direkt an.
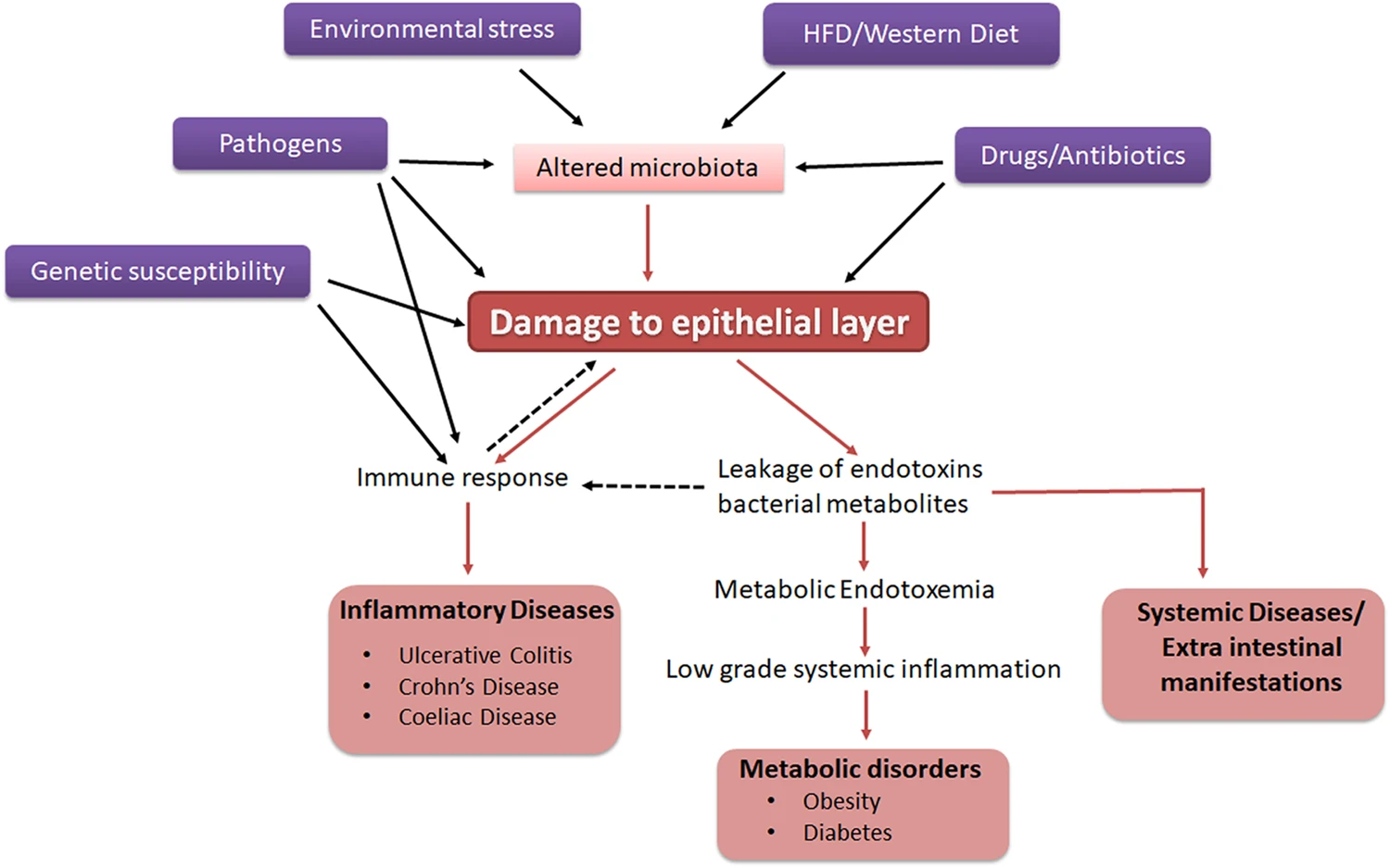
Die von den pathogenen Bakterien freigesetzten Metaboliten heften sich an die Darmschleimhaut an und stimulieren die Abwehrzellen des darmspezifischen Immunsystems. Die ausgeschütteten Botenstoffe (Zytokine) erhöhen die Darmpermeabilität und lösen Entzündungen aus – Der Darm wird löchrig.
Es scheint zudem eine genetische Komponente zu geben, die entzündliche Prozesse im Darm begünstigt. In Familien von Patienten mit Colitis Ulcerosa oder Morbus Crohn sind häufig mehrere Personen von der Krankheit betroffen. Bei diesen Erkrankungen liegt nachweislich eine Störung der Durch- und Undurchlässigkeit der Epithelbarriere vor. Ob die Dysbiose Ursache oder Folge dieser Störung ist, ist allerdings unklar [1].
Wegen der erhöhten Durchlässigkeit der Darmbarriere gelangen Entzündungsmediatoren, Nahrungsbestandteile, Bakterien und deren Toxine in den Blutkreislauf und verbreiten sich weiträumig im gesamten Körper. Diese Überflutung von Blut und Organen mit Schadstoffen und die Reaktionen des Immunsystems führen zu mannigfaltigen Beschwerden und Krankheitssymptomen.
Um die Folgen des löchrigen Darms besser zu verstehen, betrachten wir im Folgenden den Aufbau und die Funktionen des Immunsystems.
Das Immunsystem
Das Immunsystem besteht aus zwei Komponenten, die einander ergänzen, dem angeborenen (unspezifischen) und dem erworbenen (spezifischen) Immunsystem. Beim Erstkontakt mit einem Erreger dauert es etwa vier bis sieben Tage, bis die spezifischen Abwehrmechanismen des erworbenen Immunsystems die Infektion bekämpfen können. Bis die spezifische Abwehr greift, muss das unspezifische Immunsystem die Vermehrung des Pathogens eindämmen.
Zusätzlich unterscheidet man zwischen der zellulären und der humoralen Abwehr. Die zelluläre Abwehr richtet sich gegen Mikroben und Karzinogene, die in die Zellen der Organgewebe eingedrungen sind. Die humorale Abwehr bekämpft Mikroben, die in die Extrazellulärräume der Organe und Körperflüssigkeiten (Blut, Lymphe) eingedrungen sind (lat. humor = Saft, Flüssigkeit). Die nachfolgende Tabelle zeigt die Gliederung des Immunsystems mit ihren Komponenten [2].
| Komponenten | Unspezifische Abwehr | Spezifische Abwehr |
|---|---|---|
| Zellulär | Monozyten/Makrophagen Granulozyten Dendritische Zellen Natürliche Killerzellen Mastzellen |
B-Lymphozyten (B-Zellen) T-Lymphozyten (T-Zellen – zwei Untergruppen): - CD8+: zytotoxische und regulatorische T-Zellen - CD4+: T-Helferzellen |
| Humoral | Komplementsystem Zytokine Enzyme Defensine Sauerstoff- und Stickstoff-Radikale |
Antikörper (Immunglobuline): - Immunglobulin M (IgM) - Immunglobulin A (IgA) - Immunglobulin G (IgG) - Immunglobulin E (IgE) |
B-Lymphozyten
Die B-Lymphozyten der spezifischen Abwehr produzieren die Antikörper (Immunglobuline) der humoralen Abwehr. Sie kommen aus dem Knochenmark und zirkulieren zwischen dem Blut und den sekundären lymphatischen Organen. Alle B-Lymphozyten produzieren zunächst IgM. Nach Kontakt mit einem Erreger findet ein Wechsel der Antikörperklasse statt. Dabei entstehen IgA, IgG oder IgE.
T-Lymphozyten
Die Vorläuferzellen der T-Lymphozyten werden ebenfalls im Knochenmark gebildet. Sie wandern von dort in den Thymus, wo sie zu T-Zellen heranreifen, die gegen Erreger eingesetzt werden können. Die reifen T-Zellen tragen entweder einen CD4- oder einen CD8-Rezeptor an der Oberfläche. Entsprechend werden T-Lymphozyten in zwei Untergruppen eingeteilt [3*]:
- CD8-Lymphozyten: Zytotoxische T-Zellen und regulatorische CD8-T-Zellen
- CD4-Lymphozyten: T-Helferzellen
Zytotoxische T-Zellen erkennen virusinfizierte oder entartete Körperzellen und lösen den programmierten Zelltod (Apotose) aus. Regulatorische CD8-T-Zellen unterdrücken überschießende Immunantworten auf körpereigene Strukturen und harmlose Antigene. Sie hemmen also Autoimmunreaktionen.
T-Helferzellen koordinieren und steuern die spezifische Immunreaktion über die Ausschüttung von Zytokinen und die Aktivierung zusätzlicher Abwehrzellen des spezifischen und unspezifischen Immunsystems. Die Art und die Anzahl der vorhandenen T-Helferzellen beeinflussen die Ausprägung unterschiedlicher Krankheitssymptome.
Klassifikation von T-Helferzellen
CD4+-Helferzellen (TH0) differenzieren abhängig vom vorliegenden Botenstoffmilieu weiter zu verschiedenen Subtypen TH1, TH2, TH17 und Treg mit unterschiedlicher immunologischer Wirkung, wie die nachfolgende Tabelle zeigt [4].
| Botenstoffmilieu | TH0 wird zu | immunologische Wirkung |
|---|---|---|
| IL-12, IFN-γ | TH1 | Immunität gegen intrazelluläre Erreger, Tumorabwehr |
| IL-4, IL-33 | TH2 | Antikörper-vermittelte Immunität gegen extrazelluläre Erreger |
| TGF-β, IL-6, IL-23 | TH17 | Immunität gegen persistierende intrazelluläre Erreger |
| TGF-β, IL-2 | Treg | Immuntoleranz |
Dabei beeinflussen TH1- und TH2-Zellen einander wechselseitig: Bereits vorhandene TH1-Zellen unterdrücken die Aktivierung von TH2-Zellen und umgekehrt. Überwiegen die TH1-Zellen, kann es zu einer TH1-Dominanz kommen. Überwiegen die TH2-Zellen, kann daraus eine TH2-Dominanz resultieren.
Das TH1/TH2-Modell der Immunregulation
Das TH1/TH2-Modell der Helferzell-basierten Immunregulation wurde erstmals von Mosmann et al.[5] beschrieben. Es teilt die T-Helferzellen in TH1- und TH2-Zellen mit funktionell unterschiedlichen Zytokinmustern ein:
TH1-Zellen sind vor allem für die zelluläre Abwehr zuständig. Sie bekämpfen Viren sowie intrazelluläre Bakterien und Parasiten. Dabei schalten sie befallene Zellen aus, indem sie Makrophagen (Fresszellen) aktivieren. Daneben aktivieren TH1-Zellen die Produktion von Immunglobulin IgG2 und IgG3 in den B-Zellen. Weil sie Entzündungsprozesse auslösen, werden TH1-Zellen als proinflammatorische Abwehr bezeichnet.
TH2-Zellen sind die humorale Abwehr des Körpers. Sie stimulieren B-Zellen zur Herstellung der Immunglobuline IgG1, IgE und IgA, die sich anschließend in Körperflüssigkeiten und Sekreten verteilen. Sie aktivieren Mastzellen und eosinophile Granulozyten während sie die Makrophagenaktivität hemmen. TH2-Zellen wirken gegen extrazelluläre Bakterien, Pilze und Parasiten. Weil sie die TH1-Zellen und deren entzündliche Wirkung unterdrücken, gelten TH2-Zytokine als antiinflammatorisch [3*,4].
| TH1 | TH2 | |
|---|---|---|
| Partnerzellen | Makrophagen zytotoxische CD8-T-Zellen |
B-Lymphozyten eosinophile Granulozyten Mastzellen |
| Immunreaktion | Zelluläres Immunsystem: - Aktivierung von Makrophagen - Proliferation zytotoxischer CD8-T-Zellen - Produktion von IgG2 und IgG3 |
Humorales Immunsystem: - Proliferation von B-Zellen - Produktion von IgG1, IgE und IgA |
| produzierte Zytokine | IFN-γ, TNF-α, TNF-β, IL-2, IL-12, GM-CSF | IL-4, IL-5, IL-10, IL-13, IL-25 |
| Wirkung | proinflammatorisch | antiinflammatorisch |
Das polare Konzept der Immunregulation mit gegenseitiger Hemmung der TH1- und TH2-Ebene kann viele immunologische Phänomene erklären, stößt bei einigen Krankheiten jedoch an seine Grenzen. Mittlerweile wurde das TH1/TH2-Modell um die TH17-Zellen erweitert. Letztere scheinen eine wichtige Rolle bei rheumatologischen Autoimmunerkrankungen zu spielen [6].
Mit Leaky Gut assoziierte Krankheiten
Die mit Leaky Gut assoziierten Beschwerdebilder und Krankheiten lassen sich auf zwei Ursachen zurückführen: Die Entzündungsreaktionen im Darm aufgrund der Aktivierung des darmassoziierten Immunsystems (GALT) und die intestinale Selbstvergiftung durch die in den Blutkreislauf eindringenden Erreger und Fremdkörper (siehe Leaky Gut – Der löchrige Darm). Letztere lösen ebenfalls Immunreaktionen aus, die jedoch disloziert vom Darm überall im Körper auftreten können.
Silent Inflammation und „Inflammaging”
Eine sogenannte „Stille Entzündung” (Silent inflammation) bei Leaky Gut verläuft ohne die klassischen Entzündungssymptome wie Rötungen, Schwellungen, Fieber oder Schmerzen. Sie ist gekennzeichnet durch einen chronisch erhöhten Spiegel proinflammatorischer Zytokine und aggressiver Radikale wie reaktive Sauerstoffspezies (ROS) und Stickstoffmonoxid (NO). Letztere zerstören Krankheitserreger, schädigen dabei aber gleichzeitig das körpereigene Gewebe. Wegen der fehlenden Symptomatik akkumulieren sich die Schäden unbemerkt über Jahre und Jahrzehnte.
Stille Entzündungen stehen im Verdacht, den biologischen Alterungsprozess zu beschleunigen und den Verlauf von “Alters”krankheiten wie Atherosklerose, Diabetes Typ 2 oder Alzheimer zu verschlechtern [7]. Tatsächlich korreliert der im Blut gemessene Spiegel des Zytokins Interleukin-6 mit dem Risiko für Gefäßerkrankungen und einen frühen Tod [8]. Aber auch bei Erwachsenen ohne Entzündungskrankheiten steigen die Blutspiegel der Entzündungsmarker IL-6, TNFα und C-reaktives Protein mit zunehmendem Lebensalter an – ein Prozess, der auch als Inflammaging bezeichnet wird.
Übergewicht
Das in der Membran gramnegativer Darmbakterien enthaltene Toxin LPS kann sich bei Leaky Gut ungehindert im Körper verteilen. LPS stimuliert die Bildung des Enzyms 11β-Hydroxy-Steroiddehydrogenase-1 (11β-HSD-1), welches als Schlüsselenzym für die Umwandlung von Cortison in Cortisol (Glucokorticoide) im Fettgewebe gilt [9,10]. 11β-HSD-1 spielt eine zentrale Rolle bei der Regulation der Zelldifferenzierung und -reifung von Fettzellen. Eine deutliche Steigerung dieses Enzyms geht mit der Zunahme von viszeralem Körperfett einher [11]. Bei dieser sogenannten Stammfettsucht bilden sich Fettdepots vorwiegend im Bauchbereich und zwischen den Organen (siehe unten).
Im viszeralen Fettgewebe vermehren sich Makrophagen, die die proentzündlichen Zytokine TNF-α, IL-6, IL-1 und Stickstoffradikale (iNOS) produzieren [12]. Bei vielen Menschen mit Adipositas finden sich deshalb chronisch erhöhte Entzündungswerte im Blut (z. B. C-reaktives Protein). Ebenso wie die stille Entzündung im Darm bleibt auch der niedriggradige Entzündungsprozess im Bauchfett lange Zeit unbemerkt. Er erhöht unter anderem das Risiko für Insulinresistenz und Diabetes mellitus Typ 2 [13].
Autoimmunerkrankungen
Ein Teil der T-Lymphozyten, die im Thymus heranreifen, tragen Rezeptoren für körpereigene Eiweiße. Das bedeutet, sie lösen eine T-Zell-Effektorantwort auf körpereigene Strukturen (Autoimmunreaktion) aus. Autoimmunität ist also grundsätzlich ein physiologisches Phänomen. Die meisten der autoimmunen T-Zellen werden aussortiert, bevor sie den Thymus verlassen können. Die verbleibenden T-Zellen mit körpereigenen Erkennungsmerkmalen werden von den regulatorischen T-Zellen (Treg) “in Schach” gehalten, da diese unerwünschte oder überschießende Autoimmunreaktionen unterdrücken.
Wissenschaftliche Studien zeigen, dass die bei Leaky Gut in die Darmschleimhaut eindringenden Erreger und Bakteriengifte zu einer drastischen Fehlsteuerung bei der Eliminierung von T-Zellen und der Kontrolle von Autoantikörpern führen können. Leaky Gut gilt damit als bedeutendender Trigger und möglicherweise sogar als Hauptursache für Autoimmunerkrankungen [14,15].
Autoimmunerkrankungen können in TH1-vermittelte und TH2-vermittelte Krankheiten eingeteilt werden, abhängig davon, welche Zytokine produziert werden. Beispielsweise zeigt sich bei Morbus Crohn eine TH1-Dominanz, charakterisiert durch die Produktion der proentzündlichen Zytokine IFN-γ und IL-2 und der Aktivierung von Monozyten und Makrophagen [16]. Bei der Colitis ulcerosa ist hingegen eine TH2-Dominanz unter Vermittlung von IL-13 nachweisbar [17].
Die nachfolgende Tabelle zeigt eine Auswahl TH1- und TH2-vermittelter Autoimmunerkrankungen [3*,18*].
| TH1-vermittelte Erkrankungen | TH2-vermittelte Erkrankungen |
|---|---|
| Multiple Sklerose Hashimoto-Thyreoiditis Diabetes mellitus Typ 1 Morbus Crohn Rheumatoide Arthritis (TH17 ↑ ) Psoriasis (TH17 ↑ ) |
Chronisches Erschöpfungssyndrom (CFS) Morbus Basedow Fibromyalgie Colitis Ulcerosa Lupus erythematodes Progressive systemische Sklerodermie |
Auffällig ist, dass TH1-Autoimmunerkrankungen proinflammatorisch und organspezifisch sind. Das Immunsystem richtet sich selektiv gegen ein bestimmtes Organ, zum Beispiel die Schilddrüse, die Bauchspeicheldrüse oder die Nerven. Die TH2-Dominanz verursacht dagegen eher nicht-entzündliche, systemische Autoimmunerkrankungen, bei denen das Immunsystem verschiedene Körperorgane attackiert. Eine Ausnahme bildet die entzündliche Darmerkrankung Colitis Ulcerosa. Einige Quellen stufen sie als organspezifische, andere als systemische Erkrankung ein.
Die TH1-/TH2-Balance-Theorie ist bei einigen Autoimmunerkrankungen nicht ausreichend, um die Pathogenese zu erklären. so spielen in der Frühphase entzündlich-rheumatischer Gelenkerkrankungen und bei der entzündlichen Plaquepsoriasis auch T-Helferzellen vom Typ TH17 eine bedeutende Rolle. Sie sezernieren das proinflammatorische Zytokin IL-17, das Gewebeschädigungen auslöst [3*,6].
Allergien
Die Darmschleimhaut kommt aufgrund ihrer bakteriellen Besiedlung und der Nahrungsaufnahme ständig mit Antigenen in Berührung. Das intestinale Immunsystem reagiert auf diese Antigene mit einer kontrollierten Immunantwort, die ein dynamisches Gleichgewicht zwischen Toleranz und Immunität ermöglicht. Bei einem Leaky Gut hingegen kommt es bereits bei harmlosen Substanzen und Nahrungsbestandteilen zu einer Überreaktion [19].
Allergien und pseudoallergische Erkrankungen sind typische TH2-Erkrankungen [20]. TH2-Helferzellen aktivieren B-Lymphozyten, die einen zum Antigen passenden Rezepter aufweisen. Die aktivierten B-Lymphozyten teilen sich und wandeln sich in Plasmazellen um. Plasmazellen haben keine Antigenrezeptoren mehr und produzieren nur noch einen speziellen Antikörper in großen Mengen.
Die von den TH2-Zellen produzierten Zytokine IL-4 und IL-13 sorgen dabei für einen Wechsel der Immunglobulin-Klasse von IgM zu IgE. IgE-Antikörper sind verantwortlich für allergische Reaktionen. Sie binden insbesondere an Mastzellen, die unter der Haut und in den Schleimhäuten liegen und veranlassen diese zur Freisetzung von Histamin, Prostaglandinen und anderen Entzündungsbotenstoffen [21,22] (siehe Abbildung unten).
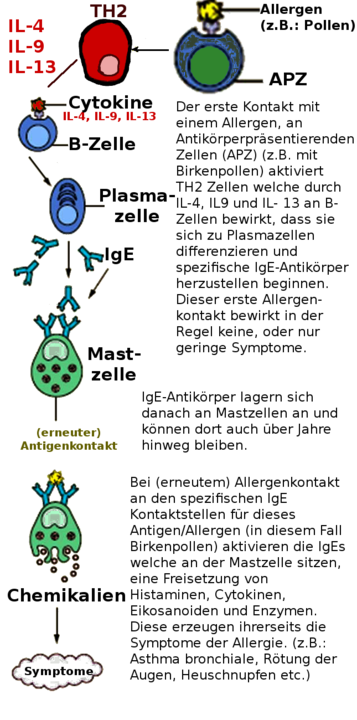
Bei einer TH2-Dominanz des spezifischen Immunsystems kommt es damit typischerweise zu allergischen Krankheitsbildern (siehe Tabelle unten 18).
| TH2-vermittelte allergische und pseudoallergische Erkrankungen |
|---|
| Typ-I-Allergie (IgE-Sofort-Typ) Asthma Chronische Rhinitis/Sinusitis Atopische Ekzeme Neurodermitis Multiple Chemikalien-Sensivität (MCS) Mastzellaktivierungssyndrom (MCAS) |
Wissenschaftliche Studien zeigen, dass alle oben genannten Krankheiten mit einer erhöhten intestinalen Permeabilität korrelieren [19,23]. Daher wäre es denkbar, dass sich der TH2-Shift des Immunsystems erst bei gleichzeitigem Vorliegen eines Leaky Gut-Syndroms als Krankheitsbild äußert.
Depression
Obwohl das Krankheitsbild der Depression als multifaktorielles Geschehen angesehen wird, liefern das Leaky Gut-Syndrom und das damit einhergegende Entzündungsgeschehen einen interessanten Erklärungsansatz. Wissenschaftliche Studien zeigen, dass die Symptome der Depression wie Niedergeschlagenheit, Antriebslosigkeit und sozialer Rückzug mit erhöhten Spiegeln der proentzündlichen Zytokine TNF-α IL-1, IL-6 und IFN-γ korrelieren [24,25].
Das Verhalten depressiver Menschen wird auch als “Sickness Behaviour” bezeichnet. Der Begriff bezeichnet eine immunologisch vermittelte Anpassungsstrategie, die der Schonung des Organismus bei chronischen Entzündungsprozessen und Infektionskrankheiten dient. Die Botenstoffe TNF-α IL-1, IL-6 und IFN-γ fördern also das Sickness Behaviour.
Die Zytokine stören zudem den Tryptophan-Stoffwechsel, indem sie die Aktivität des Enzyms Indolamin-2,3-Dioxygenase (IDO) steigern. Normalerweise wird aus Tryptophan das Hormon Serotonin hergestellt. IDO bewirkt, dass die Aminosäure Tryptophan nicht in die Serotonin-Vorstufe 5-Hydroxy-Tryptophan (5-HTP), sondern stattdessen in Kynurenin umgewandelt wird [26]. Der geänderte Stoffwechselweg führt zu einem Serotonin-Mangel bei gleichzeitigem Kynurenin-Überschuss.
Eine erhöhte IDO-Aktivität fördert Depressionen damit zweifach: 1. durch die Verknappung von Serotonin und 2. durch die Zunahme von Kynurenin und seiner neurotoxischen Metabolite (siehe Tabelle unten).
| Serotonin-Mangel | Kynurenin-Überschuss |
|---|---|
| Müdigkeit Antriebslosigkeit Reizbarkeit Ängstlichkeit gesteigertes Schmerzempfinden Schlaflosigkeit |
Neurotoxische Wirkung vermehrte Bildung von Treg, dadurch reduzierte Immunabwehr/Krankheitsanfälligkeit Hemmung der Glutamat- und Dopaminfreisetzung Verstärkung depressiver Symptomatik |
Die Gabe von Tryptophan – welches häufig zur Linderung von Schlafproblemen und depressiven Verstimmung empfohlen wird – führt bei Leaky Gut direkt in einen Teufelskreis, weil aus diesem zusätzliches Kynurenin erzeugt wird. Stattdessen empfiehlt sich bei Leaky Gut die Gabe von 5-HTP, weil dieses nur noch zu Serotonin und nicht mehr zu Kynurenin umgesetzt werden kann.
Neurodegenerative Krankheiten / Leaky Brain
Die Blut-Hirn-Schranke (BHS) ist ähnlich aufgebaut wie die Darmbarriere. Wie das Darmepithel besteht sie aus einer dünnen Schicht Epithelzellen, die über Tight Junctions miteinander verbunden sind. Um das Gehirn vor schädlichen Einflüssen zu schützen, findet über die BHS normalerweise so gut kein wie kein parazellulärer Transport statt [27]. Die BHS kann jedoch durchlässig werden.
Wissenschaftliche Untersuchungen zeigen einen direkten Zusammenhang zwischen einer geschädigten Darmbarriere und einer erhöhten Durchlässigkeit der BHS. Als Ursache werden Entzündungsprozesse vermutet, die ihren Ursprung im Darm haben [28,29]. Auch das intestinale Mikrobiom hat einen Einfluss: So sind neurodegenerative Erkrankungen mit einem erhöhten Aufkommen bakterieller Endotoxine wie LPS im Blut und im Gehirn assoziiert [30]. Umgekehrt konnte die Integrität der BHS von Labormäusen nach der bakteriellen Besiedlung des Darms mit Butyrat-produzierenden Bakterien wieder hergestellt werden [31].
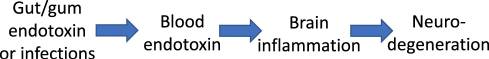
Der Zustand des „Leaky Brain” ist unter anderem mit den in der nachfolgenden Tabelle aufgelisteten neurologischen Erkrankungen assoziiert [28].
| Mit Leaky Brain assoziierte neurologische Erkrankungen |
|---|
| Autismus-Spektrum-Störung Demenz Morbus Alzheimer Morbus Parkinson Depression Schizophrenie Multiple Sklerose Gehirntumor Amyotrophe Lateralsklerose |
„Löcher” in der Blut-Hirn-Schranke lassen sich durch ein EEG nach der oralen Einnahme von Gamma-Aminobuttersäure oder durch einen Gehirn-Scan nach der Injektion des Leberproteins Albumin nachweisen [32,33]. Bei einer intakten Barriere sind die Moleküle nämlich zu groß für die Passage vom Blut ins Gehirn. Ist die Blut-Hirn-Schranke hingegen durchlässig, so werden beide Stoffe vom Gehirn aufgenommen. Tests auf Leaky Brain werden unter anderen zur Abschätzung des Risikos für die Entwicklung von Demenzerkrankungen eingesetzt [34].
Fazit
Bei Übergewicht, chronischen Krankheiten oder Allergien lohnt es sich, auf seine Darmgesundheit achten. Leaky Gut ist mit Änderungen des Lebensstils und insbesondere der Ernährung heilbar. Leider sind viele Betroffene dazu nicht bereit. Auch in der medizinischen Praxis findet das Thema bis heute kaum Beachtung. Wer sich dennoch dafür entscheidet, den schweren Weg der Eigenverantwortung zu gehen, erlebt oft ungeahnte Verbesserungen.
* Als Amazon-Partner verdiene ich an qualifizierten Verkäufen
Quellen
- Chelakkot et al. Mechanisms regulating intestinal barrier integrity and its pathological implications. Experimental & Molecular Medicine(2018) 50:103
- Der Allgemeinarzt. Ausg. 10/2012
- Strienz J. Mit meinem Immunsystem stimmt etwas nicht!: Was Sie bei Fibromyalgie, Hashimoto und anderen Erkrankungen tun können. Herausgeber: Zuckschwerdt Buch*
- Dr. med. Volker von Baehr, TH1/TH2-Dysbalance – Klinische Bedeutung, diagnostische und therapeutische Möglichkeiten, Institut für Medizinische Diagnostik Berlin, inflammatio Akademie Online-Fortbildung, 13.01.2016
- Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu Rev Immunol. 1989;7:145-173.
- Leipe, Jan & Skapenko, A. & Schulze-Koops, Hendrik. (2009). Th17-Zellen – eine neue proinflammatorische T-Zell-Population und ihre Bedeutung für rheumatologische Autoimmunerkrankungen. Zeitschrift für Rheumatologie. 68. 405-408. 10.1007/s00393-009-0473-z.
- Wikipedia – Inflammaging
- Tasnime N. Akbaraly, Mark Hamer, Jane E. Ferrie, Gordon Lowe, G. David Batty, Gareth Hagger-Johnson, Archana Singh-Manoux, Martin J. Shipley, Mika Kivimäki. Chronic inflammation as a determinant of future aging phenotypes. CMAJ Nov 2013, 185 (16) E763-E770
- Cho YS, Kim KN, Shim JH. Effects of Cellular 11β-hydroxysteroid Dehydrogenase 1 on LPS-induced Inflammatory Responses in Synovial Cell Line, SW982. Immune Netw. 2017;17(3):171-178. doi:10.4110/in.2017.17.3.171
- Stulnig, T.M., Waldhäusl, W. 11β-Hydroxysteroid dehydrogenase Type 1 in obesity and Type 2 diabetes. Diabetologia 47, 1–11 (2004).
- Bujalska IJ, Kumar S, Hewison M, Stewart PM. Differentiation of adipose stromal cells: the roles of glucocorticoids and 11beta-hydroxysteroid dehydrogenase. Endocrinology. 1999;140(7):3188-3196.
- Weisberg SP, McCann D, Desai M, Rosenbaum M, Leibel RL, Ferrante AW Jr. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest. 2003;112(12):1796-1808.
- Galic S, Oakhill JS, Steinberg GR. Adipose tissue as an endocrine organ. Mol Cell Endocrinol. 2010;316(2):129-139.
- Fasano A. Leaky gut and autoimmune diseases. Clin Rev Allergy Immunol. 2012;42(1):71-78.
- Mu Q, Kirby J, Reilly CM, Luo XM. Leaky Gut As a Danger Signal for Autoimmune Diseases. Front Immunol. 2017;8:598. Published 2017 May 23
- https://www.pharmazeutische-zeitung.de/ausgabe-052007/morbus-crohn-hilfe-fuer-den-entzuendeten-darm/
- F Heller, P Florian, C Bojarski, M Christ, J Mankertz, M Fromm, M Zeitz, JD Schulzke. Interleukin–13 hat bei Colitis ulcerosa eine zentrale Rolle und beeinflusst die intestinale Barriere, Tight-junctions, Apoptoserate und Wundheilung wesentlich. Z Gastroenterol 2004; 42 - V028
- Kristin Deppe. Neue Wege aus dem Histamin-Dilemma. Herausgeber: tredition GmbH, Hamburg Buch*
- Fukuoka A, Yoshimoto T. Barrier dysfunction in the nasal allergy. Allergology International. Volume 67, Issue 1, January 2018, Pages 18-23
- Deo SS, Mistry KJ, Kakade AM, Niphadkar PV. Role played by Th2 type cytokines in IgE mediated allergy and asthma. Lung India. 2010;27(2):66-71.
- https://www.amboss.com/de/wissen/Spezifisches_Immunsystem
- Wikipedia – Immunglobulin E
- Laurie Dennison Busby.Ecopsychology.Jun 2017.90-98.
- Dantzer R. Cytokine, sickness behavior, and depression. Immunol Allergy Clin North Am. 2009;29(2):247-264.
- Lee CH, Giuliani F. The Role of Inflammation in Depression and Fatigue. Front Immunol. 2019;10:1696. Published 2019 Jul 19.
- Wikipedia – Indolamin-2,3-Dioxygenase
- Wikipedia – Parazellulärer Transport
- Obrenovich MEM. Leaky Gut, Leaky Brain?. Microorganisms. 2018;6(4):107. Published 2018 Oct 18.
- Rahman MT, Ghosh C, Hossain M, Linfield D, Rezaee F, Janigro D, et al. IFN-γ, IL-17A, or zonulin rapidly increase the permeability of the blood-brain and small intestinal epithelial barriers: relevance for neuro-inflammatory diseases. Biochem Biophys Res Commun. (2018) 507:274–9.
- Brown GC. The endotoxin hypothesis of neurodegeneration. J Neuroinflammation. 2019;16(1):180. Published 2019 Sep 13.
- Al-Asmakh, Maha & Hedin, Lars. (2015). Microbiota and the control of blood-tissue barriers. Tissue Barriers. 3. 10.1080/21688370.2015.1039691.
- Remler MP, Marcussen WH. A GABA-EEG test of the blood-brain barrier near epileptic foci. Appl Neurophysiol. 1983;46(5-6):276-285.
- Jaffer H, Adjei IM, Labhasetwar V. Optical imaging to map blood-brain barrier leakage. Sci Rep. 2013;3:3117. Published 2013 Nov 1. doi:10.1038/srep03117
- https://www.nih.gov/news-events/nih-research-matters/blood-brain-barrier-test-may-predict-dementia






Comments powered by Talkyard.