Teilen auf
Twitter Facebook LinkedIn WhatsAppDie flächenmäßig größte Kontaktfläche des Körpers mit der Umwelt ist nicht die Haut (ca. 2 m2), sondern der Dünndarm (ca. 400 m2). Ein gesunder Dünndarm absorbiert die Nährstoffe aus der Nahrung und schützt uns vor schädlichen Eindringlingen. Wegen dieser komplexen Aufgabe besteht die Darmbarriere aus sieben verschiedenen Schichten, von denen jede eine bestimmte Funktion erfüllt.
Die innerste physikalische Barriere bildet die Darmschleimhaut mit ihren Eptithelzellen und Zwischenzellverbindungen. Ihre Integrität ist entscheidend für die Gesundheit des gesamten Organismus. Warum sie dennoch löchrig werden kann und welche Konsequenzen sich daraus ergeben, erfährst Du in diesem Artikel.
Tight Junctions – die Endothelbarriere
Das mit einer Mukusschicht überzogene Epithel besteht aus einer einzelligen Schicht von Endothelzellen, die für Nährstoffe und Wasser durchlässig sind und gleichzeitig pathogene Keime und Erreger aussperren. Für den Stofftransport durch das Epithel existieren zwei Wege: Der transzelluläre Transport über die Saumzellen oder der parazelluläre Transport durch die Kanäle zwischen den Epithelzellen. Letztere werden durch dynamische Eiweißstrukturen – die Tight Junctions – in ihrer Breite reguliert (siehe Abbildung unten).
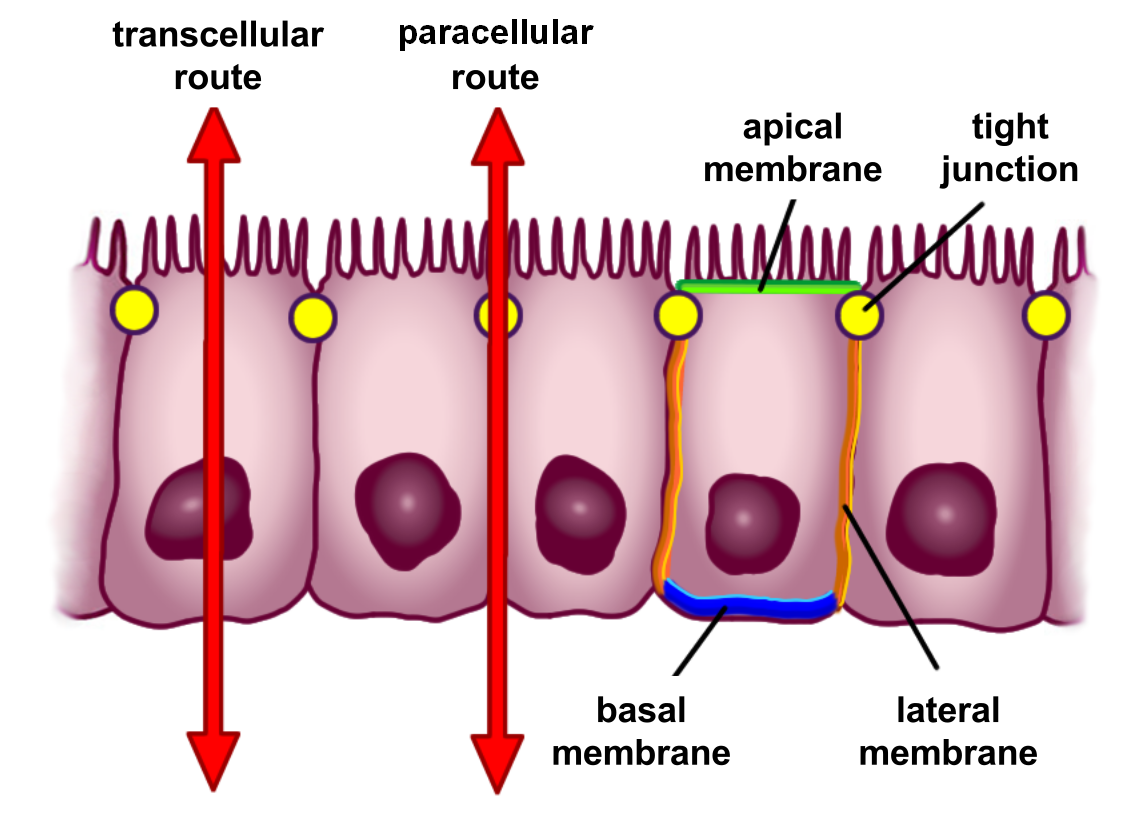
Die Tight Junctions der Dünndarmschleimhaut sind selektiv durchlässig. Das heißt, dass einige Stoffe das Epithel in größeren Mengen passieren können als andere. Beispielsweise ist der parazelluläre Transportweg für Kalium-Ionen (K+) viermal durchlässiger als für Chlorid-Ionen (Cl-) [1].
Die Regulation der Tight Junctions
Tight Junctions sind nicht statisch, sondern reagieren auf verschiedene extrazelluläre Reize (Stimuli) mit einer Enger- oder Weiterstellung der Kanäle. Ein Auslöser ist zum Beispiel die Glukosekonzentration im Darmlumen. Grundsätzlich wird der Einfachzucker Glukose mit Hilfe des Natrium/Glucose-Cotransporters 1 (SGLT1) durch die Saumzellen ins Blut transportiert. Überschreitet der Zuckergehalt jedoch die intrazelluläre Transportkapazität, öffnen sich die Tight Junctions für den parazellulären Transport. Auf diese Weise kann der Darm große Mengen Zucker in kurzer Zeit absorbieren [1].
Auch das Protein Zonulin beeinflusst die Permeabilität der Tight junctions. Es wird bei bestimmten Reizen von den Enterozyten der Darmschleimhaut sezerniert und bindet an spezifische Rezeptoren, wo es zu einer reversiblen Öffnung der interepithelialen Kanäle führt. Zonulin ist bis heute das einzige bekannte intestinale Regulatorprotein für die Tight Junctions.
Der Einfluss des Mikrobioms
Das intestinale Mikrobiom hat über seine Stoffwechselprodukte direkten Einfluss auf die Festigkeit der Tight Junctions. So stimuliert das von der Säuerungsflora produzierte Butyrat die Biosynthese der Membranproteine, aus denen die Tight Junctions aufgebaut sind und stärkt auf diese Weise die Barrierefunktion [2]. Der beste Schutz für das Darmepithel ist also eine Darmflora, die reich an Butyrat-produzierenden Bakterien wie zum Beispiel Clostridium Tyrobutyricum und Faecalibacterium prausnitzii (beide vom Bakterienstamm Firmicutes) ist.
Pathogene Keime und Parasiten hingegen produzieren Toxine, die sich an das Epithel anhaften und über verschiedene Entzündungsbotenstoffe (proinflammatorische Zytokine) die Morphologie der Tight Junctions verändern und so die Darmschleimhautbarriere zerstören. Zu ihnen gehören Bakterien wie Clostridium perfringens oder Salmonella typhimurium [3]. Auch Infektionen mit Enteropathogenen Escherichia Coli-Bakterien (EPEC) oder mit dem Parasiten Giardia Lamblia führen zum Verlust der Barrierefunktion [1]. Der resultierende Zustand der erhöhten Darmdurchlässigkeit wird als Leaky Gut (löchriger Darm) bezeichnet.
Der Einfluss der Ernährung
Verarbeitete Lebensmittel enthalten neben viel Zucker und Salz Zusätze wie Geschmacksverstärker, Konservierungsmittel, Emulgatoren, Süßstoffe und gehärtete Fette. In Gemüse und Fleisch finden sich Rückstände von Pestiziden, Medikamenten und anderen Schadstoffen. Das im Ackerbau verwendete Saatgut stammt meist von gentechnisch veränderten Pflanzen. Viele dieser Lebensmittelzusätze und gentechnisch veränderten Pflanzen stehen im Verdacht, die Tight Junctions zu kompromittieren.
Zu den ernährungsbedingten Ursachen des Leaky Gut-Syndrom wurden diverse wissenschaftliche Studien durchgeführt. Einige Inhaltsstoffe haben sich als besonders schädlich herausgestellt. Die nachfolgende Liste entstammt einer Studie, die 2015 im Journal Autoimmunity Reviews veröffentlicht wurde.
Zucker in hohen Konzentrationen erhöht kurzzeitig die Durchlässigkeit der Darmschleimhaut über die Aktivierung des parazellulären Transportwegs. Allerdings kann Glukose die Festigkeit der Tight Junctions auch dauerhaft beeinträchtigen. Offenbar besteht ein Zusammenhang zwischen Zuckerkonsum und einer löchrigen Darmbarriere [4]. Gezuckerte Getränke sind besonders schädlich, weil sie den Darm wortwörtlich mit Zucker überfluten.
Salz führt in großen Mengen über die Aktivierung des Transportmoleküls SGLT1 ebenfalls zu einer Abnahme der Barrierestabilität [5]. Von der Nahrungsmitelindustrie wird Salz großen Stil verwendet. In manchen Fertiggerichten ist 100 mal soviel Salz enthalten wie in vergleichbaren, selbst zubereiteten Mahlzeiten [4].
Emulgatoren / Tenside sind Substanzen, die zwei Flüssigkeiten, die sich normalerweise nicht miteinander vermischen lassen, in eine fein durchmischte Flüssigkeit – die Emulsion – verwandeln. Sie sorgen für die saftige und cremige Konsistenz industriell verarbeiteter Speisen und Getränke. Weil Emulgatoren die Oberflächenspannung herabsetzen, greifen sie die wasserabweisende Mukusschicht im Darm an und brechen die Tight Junctions auf [4].
Organische Lösungsmittel wie Alkohol und die Alkoholmetabolite Ethanol, Acetaldehyd und Methylethanol, die als Nebenprodukte bei der alkoholischen Gärung entstehen, verändern die strukturbildenden Eiweiße der Tight Junctions. Andere organische Lösungsmittel wie Paradichlorbenzol sind mit dem Auftreten und der Verschlechterung entzündlicher Autoimmunerkrankungen assoziiert [4]. Paradichlorbenzol wird bis heute in Pestiziden eingesetzt [6]
Gluten bezeichnet die beiden Getreideeiweiße Glutelin und Prolamin, die bei Kontakt mit Wasser eine klebrige Konsistenz entwickeln und Brot und Gebäck ihre geschmeidige Festigkeit verleihen. Das Prolamin im Weizen wird als Gliadin bezeichnet. Es bindet an den sogenannten CXCR3-Rezeptor in der Darmschleimhaut, wo es die Ausschüttung von Zonulin triggert, welches die Tight Junctions öffnet. Bei genetisch vorbelasteten Personen löst Gliadin die Autoimmunerkrankung Zöliakie aus, allerdings kann es auch bei Menschen ohne Zöliakie zum Leaky Gut-Syndrom führen [4,7].
Gluten ist in vielen industriell verarbeiteten Lebensmitteln enthalten, zum Beispiel in Gerstenmalzextrakt, das unter anderem als Süßungsmittel eingesetzt wird. Zudem ist der Glutengehalt von Brot und Backwaren aufgrund moderner Weizenzüchtungen und industrieller Herstellungsprozesse ohne Sauerteiggärung heute sehr viel höher als noch vor wenigen Jahrzehnten.
Mikrobielle Transglutaminase (MT) – sogenannter “Fleischkleber” – ist ein Enzym, das von dem Bakterium Streptomyces mobaraensis (Streptoverticillium species) produziert wird. MT führt zur Vernetzung und damit zur Gelbildung von Proteinen. Es wird von der Lebensmittelindustrie unter anderem verwendet für
- die Herstellung von restrukturiertem Fleisch (Formfleisch) und Surimi (Fischgel),
- als Fettersatz in Brüh- und Rohwurst,
- zur Reduzierung des Wasserverlusts beim Auftauen von tiefgefrorenem Fisch und
- zur Verbesserung der Textur von Cremes aus Magermilchpulver, fettarmen Milchprodukten, fettarmen Desserts und Eis [8*].
Zusammen mit Nahrungsproteinen kann MT Strukturen (Epitope) bilden, die vom spezifischen Immunsystem als Antigene erkannt werden und eine Immunantwort auslösen, die zu Anomalien der Tight Junctions führen kann. Einige Epitope, die strukturell vergleichbar mit Gluten sind, lösen bei Zöliakie-Patienten entsprechende Probleme aus. Nicht zuletzt wirken MT aufgrund ihrer proteinvernetzenden Eigenschaften auch als Emulgatoren [4].
Nanopartikel mit einer Größe von 1 bis 100 nm (10–9 m) erhöhen aufgrund ihrer besonderen Eigenschaften und Oberflächenbeschaffenheit die Absorption von Makromolekülen durch die Darmbarriere. Deshalb werden sie von der Pharmaindustrie verwendet, um die Bioverfügbarkeit von Medikamenten zu steigern.
Nanopartikel sind ein gängiger Zusatz in vielen Produkten der Lebensmittelindustrie: Siliziumoxid-Nanopartikel (E551) in Instantsuppen, Kaffeepulver und Salz verhindern, dass diese verklumpen. Kaugummis, Dragees, Zuckerguss und helle Soßen enthalten das Pigment Titandioxid (E171), damit sie weiß strahlen.
In Laboruntersuchungen erhöhten Nanopartikel die Darmdurchlässigkeit, indem sie die Tight Junctions öffneten und die Anordnung ihrer membranbildenden Proteine veränderten [4]. Im Darm von Mäusen bewirkten sie die Ausschüttung des Entzündungsbotenstoffes Interleukin-1β. Letzterer scheint an der Entstehung entzündlicher Autoimmunerkrankungen beteiligt zu sein [9].
Insgesamt hat unsere moderene Ernährungsweise nur noch wenig mit der Ernährung unserer steinzeitlichen Vorfahren gemein. Diese lässt sich wohl am ehesten mit der Ernährung heute noch lebender Naturvölker vergleichen. Epidemiologische Studien zeigen, dass die sogenannte Western Diet mit dem Auftreten chronischer Erkrankungen wie Diabetes oder Krebs in Industriestaaten korreliert.
Stress
Das zentrale Nervensystem (ZNS) und der Gastrointestinaltrakt sind über das enterische Nervensystem (ENS) eng miteinander verbunden. Das als Bauchhirn bezeichnete Geflecht aus Nervenzellen befindet sich zwischen den Muskeln des Verdauungsapparates und reguliert physiologische Darmfunktionen wie die Motilität, die Sekretion von Verdauungssäften und die Ausschüttung von Hormonen und Neurotransmittern. Es arbeitet autonom, unterliegt dabei jedoch den Einflüssen von Parasymphatikus und Symphatikus.
Gehirn und Darm kommunizieren im Wesentlichen über zwei Achsen: Über die Nervenachse Gehirn-ZNS-ENS und über die hormonelle Achse Hypothalamus-Hypophyse-Nebenniere. Zusammen bilden sie die Darm-Hirn-Achse. Stress oder Angst führen deshalb meist auch zu gastrointestinalen Symptomen wie Verdauungsstörungen, Durchfall oder Bauchschmerzen. Häufiger oder anhaltender Stress kann schließlich zu einer Dysregulation der Darm-Hirn-Achse führen. Eine besondere Rolle bei der Stressreaktion spielt der Corticotropin Releasing Factor (CRF) – ein Hormon, dass die Darmmotilität beeinflusst, Entzündungen fördert und die Darmpermeabilität erhöht [10].
Stress kann sowohl durch psychische Ursachen wie traumatische Erlebnisse, Mobbing oder Leistungsdruck als auch durch physische Faktoren wie schwere Verletzungen oder zu intensives Training (Übertraining) bedingt sein. Vor allem chronischer Stress erhöht das Risiko für gastrointestinale Erkrankungen wie der Reflux-Krankheit, Reizdarm oder chronisch-entzündliche Darmerkrankungen [10].
Leaky Gut – Der löchrige Darm
Die pathologisch erhöhte Durchlässigkeit der parazellulären Eptihelbarriere aufgrund dysfunktionaler oder deformierter Tight Junctions wird als löchriger Darm beziehungsweise Leaky Gut bezeichnet. Durch die offenen Kanäle dringen Nahrungsbestandteile, Keime und Toxine aus dem Darmlumen in die Darmschleimhaut ein, die unter normalen Umständen zu groß für den Transport wären (siehe Abbildung). Von dort wandern sie ins Blut und lösen Immunreaktionen aus.
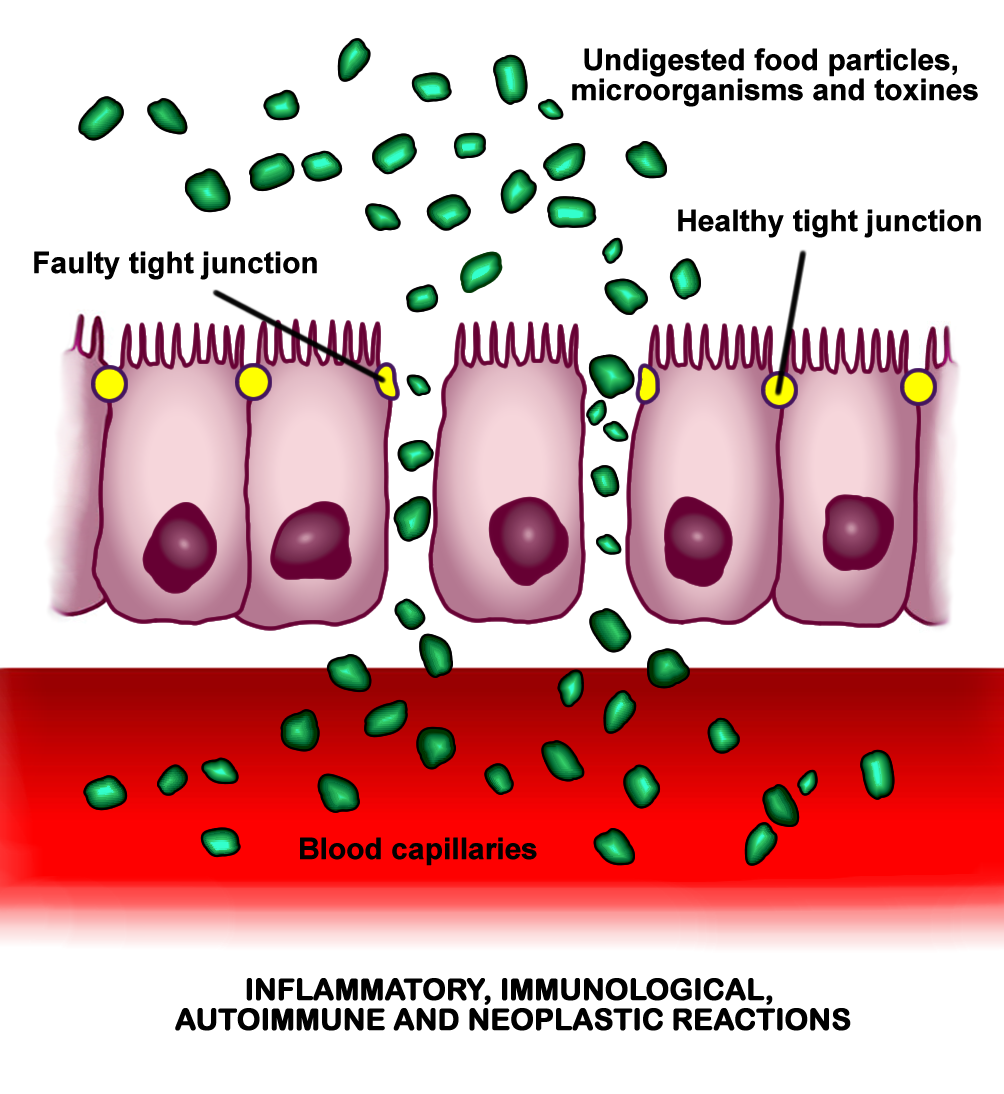
Zu den bakteriellen Toxinen gehören Lipopolysaccharide in der Zellhülle gramnegativer Keime (z. B. Escherichia coli und Klebsiella aerogenes), die nach dem Eindringen in die Darmschleimhaut die Ausschüttung proinflammatorischer Botenstoffe (Zytokine) triggern. Eine Folge der Endotoxämie ist eine niedriggradige chronische Entzündung (Silent Inflammation) [11].
Leaky Gut und Entzündungen
Weil proinflammatorische Zytokine die intestinale Permeabilität vergrößern, entsteht ein Teufelskreis, der verhindert, dass sich die beschädigten Tight Junctions regenerieren. Zu diesen Zytokinen gehören die Interleukine IL-1ß, IL-6, IL-8, der Tumor-Nekrose-Faktor TNF-α und das Interferon IFN-ɣ. So werden bei chronisch-entzündlichen Darmerkrankungen wie Morbus Crohn in der Darmschleimhaut hohe Mengen an TNF-α und IFN-ɣ nachgewiesen [1].
Durch die entzündlich erhöhte Permeabilität der Tight Junctions dringen weitere pathogene Keime und Erreger in das Innere der Darmwand ein, wo sie die dort ansässigen Immunzellen aktivieren (siehe Abbildung [13]):
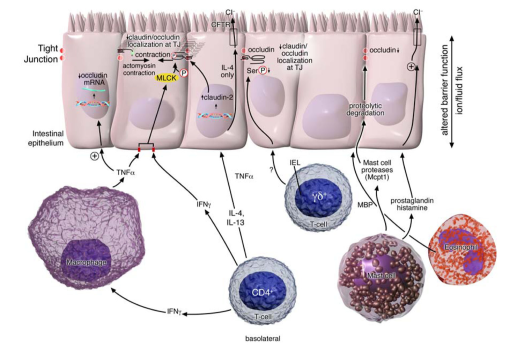
Quelle: Groschwitz KR, Hogan SP. Intestinal barrier function: molecular regulation and disease pathogenesis. J Allergy Clin Immunol. 2009;124(1):3‐22
Makrophagen sind Fresszellen des angeborenen Immunsystems, die eingedrungene Erreger vernichten. In Anwesenheit bakterieller Endotoxine und proinflammatorischer Zytokine vermehren sich vor allem Makrophagen des Phänotyps M1. Letztere produzieren Stickstoffradikale (NO-Synthase), die zytotoxisch auf die Epithelzellen wirken. Zusätzlich schütten sie die proentzündlichen Zytokine IL-1ß, IL-6, TNF-α aus. Hohe Konzentrationen von M1-Makrophagen und TNF-α finden sich in der Darmschleimhaut von Menschen mit chronisch-entzündlichen Darmerkrankungen [12].
T-Lymphozyten (T-Zellen) vom Typ CD4+ erhöhen in Studien an Mäusen sowohl die transzelluläre als auch die parazelluläre Durchlassigkeit der Epithelzellen. Über die Ausschüttung der Zytokine TNF-α, IFN-ɣ, IL-4 und IL-13 verändern sie zudem die Proteinstruktur der Tight Junctions [13]. IL-4 und IL-13 gelten als Schlüsselmediatoren von TH2-Immunerkrankungen wie der atopischen Dermatitis und allergischem Asthma.
Mastzellen setzen Entzündungsbotenstoffe wie Histamin, Serin-Proteasen, Prostaglandine und Zytokine wie TNF-α, IL-3, IL-4, IL-5, IL-6 and GM-CSF frei. Histamin verändert die Membranprotein der Tight Junctions, so dass diese nicht mehr aneinander haften [13]. Weil es auch die Wände der Kapillargefäße durchlässig macht, können Proteine aus den Gefäßen in das umliegende Gewebe austreten und weitere Immunreaktionen auslösen.
Eosinophile Granulozyten enthalten in ihrem Inneren Proteine wie das Major Basic Protein (MBP) oder Peroxidase, die beim Kontakt mit bestimmten Antikörpern abgegeben werden. MBP wirkt toxisch auf die Epithelzellen, öffnet die Tight Junctions und regt die Mastzellen zur Ausschüttung von Histamin an [13,14].
Intestinale Selbstvergiftung
Der Franzose C. Bouchard prägte 1887 den Begriff der intestinalen Autointoxikation, also der Selbstvergiftung durch Noxen aus dem Darm: Über die undichte Epithelbarriere gelangen unvollständig gespaltene Nahrungsbestandteile, bakterielle und mykotische Stoffwechselendprodukte und Umweltschadstoffe in den Blutkreislauf und die Lymphwege und verteilen sich im gesamten Organismus.
Welche Schadstoffe enstehen, hängt von der Ernährung und der Zusammensetzung des Mikrobioms ab. So ließen sich im Stuhl, im Blut, im Harn und in der Atemluft alkoholabstinent lebender Personen nach dem Verzehr von Kohlenhydraten die alkoholischen Gärungsgifte Methanol, 1-Butanol und 1-Propanol nachweisen – ein Phänomen, das als Auto-brewery Syndrome bezeichnet wird 15.
Bei einer Eiweißfäulnis hingegen entstehen aus Aminosäuren im Darm biogene Amine wie Histamin, Skatol, Cadaverin oder das Giftgas Ammoniak [16]. In der Blutbahn werden die Fäulnisgifte zunächst von der Leber entgiftet. Bei einer chronischen Vergiftung durchbrechen sie schließlich die Leberbarriere, gelangen in den großen Blutkreislauf und können sich von da auf alle Zellen und Organe auswirken. Häufig auftretende Symptome sind unter anderem [15*]:
- Müdigkeit, Benommenheit (“Brain Fog”), Wetterfühligkeit
- Kopfschmerzen, Migräne
- Gereiztheit, Aggressivität, Depressionen
- Gelenkschmerzen, Rückenschmerzen, Hauterkrankungen
Weil die Darmgifte auch die Darmperistaltik unterdrücken, kann sich die durchschnittliche Durchlaufzeit der Nahrung vom Essen bis zum Ausscheiden von gesunden 24 bis 28 Stunden auf zwei und mehr Tage verlängern. Mit der längeren Verweildauer steigt die Giftbelastung des Organismus.
Ein unerkanntes Problem
Weil die Tight Junctions nur mit dem Elektronenmikroskop sichtbar sind, kann das Leaky-Gut-Syndrom bei einer normalen Darmspiegelung nicht diagnostiziert werden. Auch wird der löchrige Darm von einigen Schulmedizinern bis heute nicht als Krankheitsbild anerkannt. Gleichzeitig erscheinen immer neue wissenschaftliche Studien, die einen Zusammenhang zwischen Leaky Gut und dem Auftreten von Zivilisationskrankheiten belegen. In meinem nächsten Artikel lernst Du einige Krankheiten kennen, die mit Leaky Gut assoziiert werden.
* Als Amazon-Partner verdiene ich an qualifizierten Verkäufen
Quellen
- Clayburgh, D., Shen, L. & Turner, J. A porous defense: the leaky epithelial barrier in intestinal disease. Lab Invest 84, 282–291 (2004)
- Al-Asmakh, Maha & Hedin, Lars. (2015). Microbiota and the control of blood-tissue barriers. Tissue Barriers. 3. 10.1080/21688370.2015.1039691.
- Eichner M, Protze J, Piontek A, Krause G, Piontek J. Targeting and alteration of tight junctions by bacteria and their virulence factors such as Clostridium perfringens enterotoxin. Pflugers Arch. 2017;469(1):77‐90
- Lerner A, Matthias T. Changes in intestinal tight junction permeability associated with industrial food additives explain the rising incidence of autoimmune disease. Autoimmun Rev. 2015;14(6):479‐489.
- Nusrat A, Turner JR, Madara JL. Molecular physiology and pathophysiology of tight junctions. IV. Regulation of tight junctions by extracellular stimuli: nutrients, cytokines, and immune cells. Am J Physiol Gastrointest Liver Physiol. 2000;279(5):G851‐G857. doi:10.1152/ajpgi.2000.279.5.G851
- Wikipedia – 1,4-Dichlorbenzol
- de Punder K, Pruimboom L. The dietary intake of wheat and other cereal grains and their role in inflammation. Nutrients. 2013;5(3):771‐787. Published 2013 Mar 12. doi:10.3390/nu5030771
- Klaus Lösche. Enzyme in der Lebensmitteltechnologie. Herausgeber: Behr’s GmbH Buch*
- Winkler, Hans & Kornprobst, Julian & Wick, Peter & von Moos, Lea & Trantakis, Ioannis & Schraner, Elisabeth & Bathke, Barbara & Hochrein, Hubertus & Suter, Mark & Naegeli, Hanspeter. (2017). MyD88-dependent pro-interleukin-1β induction in dendritic cells exposed to food-grade synthetic amorphous silica. Particle and Fibre Toxicology. 14. 10.1186/s12989-017-0202-8.
- Konturek PC, Brzozowski T, Konturek SJ. Stress and the gut: pathophysiology, clinical consequences, diagnostic approach and treatment options. J Physiol Pharmacol. 2011;62(6):591‐599
- http://www.gesundheits-lexikon.com/Uebergewicht-Stoffwechsel-Diabetes-mellitus-/Subklinische-Inflammation/Ursachen.html
- Schumann, Michael & Batra, Arvind & Kredel, Lea-Isabel & Kühl, Anja & Erben, Ulrike & May, Claudia & Schulzke, Jörg & Siegmund, Britta. (2015). Monocyte and M1 Macrophage-induced Barrier Defect Contributes to Chronic Intestinal Inflammation in IBD. Inflammatory bowel diseases. 21. 10.1097/MIB.0000000000000384.
- Groschwitz KR, Hogan SP. Intestinal barrier function: molecular regulation and disease pathogenesis. J Allergy Clin Immunol. 2009;124(1):3‐22
- Wikipedia – Major Basic Proteins
- Rauch E. Lehrbuch der Diagnostik und Therapie nach F. X. Mayr: Kriterien des Krankheitsvorfeldes, der Gesundheit und Krankheit. Herausgeber: Karl F. Haug Buch*
- Alvarez WC. Intestinal autointoxication. Physiol Rev. 1924;4:352–93.





Comments powered by Talkyard.