Teilen auf
Twitter Facebook LinkedIn WhatsAppStickstoffmonoxid (NO•) ist ein kleines reaktionsfreudiges Molekül, das bei Temperaturen von über 1000°C aus Stickstoff (N2) und Sauerstoff (O2) gebildet wird. Sein Geburtsort sind Verbrennungmotoren und Schornsteine, weshalb es zu den Luftschadstoffen zählt. Mit seinem ungepaarten Elektron oxidiert es so ziemlich alles, was sich ihm in den Weg stellt. In hohen Konzentrationen inhaliert verätzt es die Atemwege und bringt den Sauerstofftransport im Blut zum Erliegen.
Doch das kleine Radikal entsteht nicht nur bei Verbrennungsprozessen, sondern auch bei 37°C Körpertemperatur in unseren Zellen. Dort erfüllt NO• eine Vielzahl von biologischen Funktionen. Eine Wirkung hat die Fachwelt derart überwältigt, dass ihre Entdecker 1998 mit dem Nobelpreis für Medizin geadelt wurden.
Entstehung
Stickstoffmonoxid ist ein farb- und geruchloses Gas, das im Körper mithilfe des Enzyms Stickstoffmonoxid-Synthase (NOS) aus der Aminosäure L-Arginin und molekularem Sauerstoff (O2) erzeugt wird:
L-Arginin + O2 ⟶ L-Citrullin + H2O + NO•
Als Nebenprodukte entstehen die Aminosäure L-Citrullin und Wasser. Es handelt sich um eine Kurzschlussreaktion des Harnstoffzyklus, für die NADPH, Tetrahydrobiopterin (BH4), FAD und FMN als Cofaktoren benötigt werden [1,2]. Die Gleichung oben ist stark vereinfacht, den exakten Reaktionsablauf zeigt die Abbildung unten.

Die NO-Synthase existiert in vier Varianten (Isoformen) und ist abhängig vom Zelltyp, in dem NO• produziert wird:
| NOS | Bezeichnung | Vorkommen |
|---|---|---|
| eNOS | Endotheliale NO-Synthase | Endothelzellen der Blutgefäße |
| nNOS | Neuronale NO-Synthase | Neuronen (Nervenzellen), Gliazellen (Nervenhüllgewebe), bestimmte Epithelzellen (z.B. der Lunge, des Uterus und des Magens), Inselzellen des Pankreas |
| iNOS | Induzierbare NO-Synthase | neutrophile und eosinophile Granulozyten, Makrophagen, Mastzellen, Keratinozyten, Fibroblasten, Dendritische Zellen |
| mtNOS | Mitochondrielle NO-Synthase | Mitochondrien |
Ob die mtNOS als eigene Isoform existiert oder ob es sich bei ihr um eine in die Mitochondrien translozierte eNOS, nNOS oder iNOS handelt, ist nicht abschließend geklärt [3]. Aus diesem Grund werden in der Literatur häufig nur die ersten drei Isoformen beschrieben.
Biologische Wirkung
Stickstoffmonoxid hat in biologischen Systemen eine Lebensdauer von 2 bis 3 Sekunden und kann frei durch Zellmembranen diffundieren. Es hat eine größere Reichweite als Wasserstoffperoxid, denn H2O2 wird in der Regel abgebaut, bevor es die Zellgrenze passieren kann (durch H2O2-abbauende Enzyme wie Katalase). Damit ist NO• das einzige Radikal, welches unter physiologischen Bedingungen in benachbarte Zellen eindringen kann – mit bemerkenswerten Effekten:
Vasodilatation
Im Jahr 1980 erkannte der Pharmakologe Robert F. Furchgott, dass die Endothelzellen von Blutgefäßen eine unbekannte Substanz produzieren, die die Gefäßmuskulatur entspannt. Sie bekam den Namen EDRF (Endothelium-Derived Relaxing Factor). Erst 1987 konnten die späteren Nobelpreisträger Furchgott, Ignarro und Murad zeigen, dass es sich bei EDRF um NO• handelt.
Gebildet wird das Stickstoffmonoxid von der eNOS in den Zellmembranen der Endothelzellen. Von dort aus kann sich das Enzym in das Zytosol und in andere Zellkompartimente verlagern [4]. Das von der eNOS produzierte NO• diffundiert in die Muskelschicht, wo es über eine Signalkaskade zur Relaxierung der glatten Muskelzellen und so zur Weitstellung des Blutgefäßes führt (Bild unten).
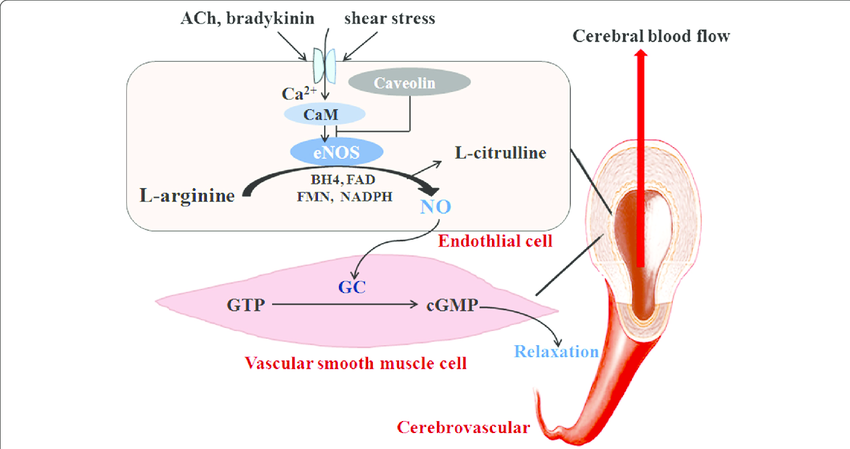
Stimuliert wird die eNOS von der Scherspannung des fließenden Blutes. Steigt der Blutdruck, bildet das Enzym mehr NO• und das Gefäß weitet sich. Neben physikalischen Reizen reagieren Endothelzellen auch auf bestimmte Botenstoffe mit der Freisetzung von Stickstoffmonoxid. Zu den vasoaktiven Botenstoffen gehören zum Beispiel Acetylcholin, Bradykinin, Histamin oder Serotonin.
Die von der eNOS katalysierte NO•-Produktion ist sauerstoffabhängig. Fällt der Sauerstoffgehalt im Blut (Hypoxie), tritt ein Notfallprogramm inkraft: Enzyme wie Hämoglobin, Xanthinoxidase oder Cytochrom P450 bilden NO•, um die Blutzufuhr im ischämischen Gewebe zu erhöhen. Gespeist wird die Produktion dann nicht mehr aus L-Arginin, sondern aus den im Blut enthaltenen Nitraten [6].
Stickstoffmonoxid als Herzmedikament
NO•-Donatoren wie Glyceroltrinitrat werden für die symptomatische Behandlung von Herzinsuffizienz, Angina Pectoris und Herzinfarkt eingesetzt. Durch die induzierte Weitstellung der venösen Gefäße muss das Herz weniger arbeiten und der Sauerstoffbedarf des Herzmuskels sinkt. Die Behandlung ist rein symptomatisch. Eine Weitung der atherosklerotisch verengten Koronararterien mit NO• ist nicht möglich, da diese Gefäße ihre Elatizität eingebüßt haben [7].
Neurotransmitter
In den Neuronen und Gliazellen des Nervensystems wird Stickstoffmonoxid von der nNOS katalysiert. NO• ermöglicht Wechselwirkungen zwischen Neuronen, die nicht durch Synapsen miteinander verbunden sind. Stickstoffmonoxid wirkt deshalb als atypischer Neurotransmitter und Neuromodulator.
Besonders aktiv ist die nNOS in den nitrergen Neuronen des Gehirns, wo NO• an der Neurogenese, Gedächtnisbildung und Verhaltenssteuerung beteiligt ist. Im peripheren Nervensystem entspannt Stickstoffmonoxid die glatte Muskulatur von Lunge, Verdauungsorganen und Urogenitaltrakt und weitet die Gefäße [8]. Vor allem der Darm verfügt über sehr viele NO-bildende Neuronen, welche die Motilität die Sekretion von Enzymen steuern.

NO• sorgt auch für die Erektion des Penis. Bei sexueller Erregung lässt es die Muskulatur der blutzuführenden Arterien erschlaffen. Der Schwellkörper füllt sich mit Blut und drückt auf die Venen, so dass das Blut nicht mehr abfließen kann. Ist die Aktivität der nNOS reduziert, können Potenzprobleme auftreten. Ursache kann eine nNOS-Entkopplung (NOS uncoupling) sein, bei der das Enzym das Sauerstoffradikal Superoxid (O2–•) anstelle von Stickstoffmonoxid produziert [9].
Immunabwehr
Aktivierte Makrophagen sowie neutrophile und eosinophile Granulozyten des angeborenen Immunsystems exprimieren die induzierbare NO-Synthase (iNOS). Das von den Immunzellen produzierte NO• wirkt bakterizid und bekämpft – gemeinsam mit reaktiven Sauerstoffspezies und Lysozym – phagozytierte Krankheitserreger. Induziert wird die iNOS-Expression durch proinflammatorische Zytokine wie IL-1, IFN-γ oder TNF-α oder bakterielle Endotoxine [1] (Bild unten).
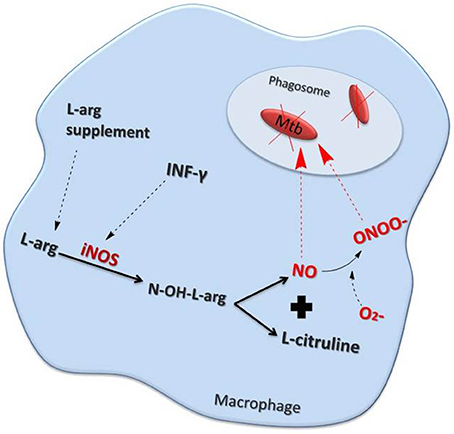
Die iNOS nimmt unter den NOS-Isoformen eine Sonderstellung ein. Je nach Schweregrad einer Infektion oder Entzündung produziert sie bis zu 1000 Mal mehr Stickstoffmonoxid pro Minute als die anderen drei Isoformen.
So steigt die NO•-Konzentration in der Ausatemluft bei einer Atemwegsentzündung messbar an. Anhand der gemessenen NO•-Konzentration lässt sich beispielsweise der Schweregrad einer asthmatischen Entzündung bestimmen. Auch bei Psoriasis wird die iNOS exprimiert: Die Keratinozyten befallener Hautareale setzten zwischen 100 und 1000 Mal mehr Stickstoffmonoxid frei als gesunde Haut. Dabei korreliert die NO•-Menge mit dem Schweregrad und der Dauer der Erkrankung [11,12].
Aber auch ohne Entzündung produziert die Nasenschleimhaut fortwährend Stickstoffmonoxid. Denn mit jedem Atemzug dringen potenziell schädliche Viren und Keime in die Atemwege ein, die durch NO• unschädlich gemacht werden. Deshalb schützt Nasenatmung besser vor der Ansteckung mit Krankheitserregern als Mundatmung.
Stickstoffmonoxid als Teil der Hautbarriere
NO• wird über einen NOS-unabhängigen Mechanismus auch auf der menschlichen Haut produziert. Verantwortlich sind die auf der Hautoberfläche befindlichen Bakterien. Sie wandeln das Nitrat aus dem Schweiß durch die Nitratreduktase in Nitrit um. Letzteres wird aufgrund des leicht sauren Milieus von auf der Hautoberfläche (pH-Wert ≈ 5,5) weiter zu NO• reduziert. In Studien wurde nachgewiesen, dass Schwitzen einen deutlichen Anstieg der NO•-Werte bewirkt, ebenso wie ein Absenken des Haut-pH-Werts. Bei Patienten, die langfristig Tetracyclin-Antibiotika einnahmen, war die NO•-Synthese der Haut dagegen signifikant reduziert [13,14].
Signalmolekül
Als Signalmolekül spielt Stickstoffmonoxid bei vielen biologischen Vorgängen eine bedeutende Rolle. Tatsächlich gibt es kaum einen physiologischen Prozess, der nicht wenigstens indirekt durch NO• beeinflusst wird. Die vielfältigen Wirkungen der Isoformen der NO-Synthase fasst das untenstehende Bild zusammen.
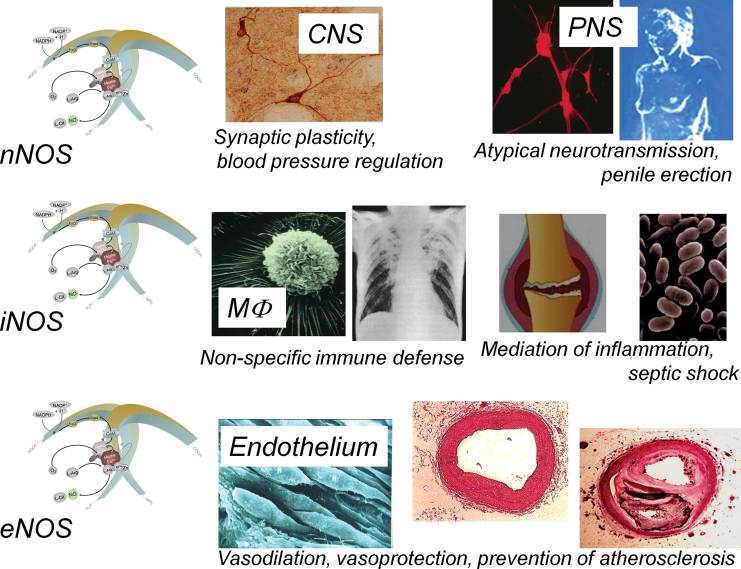
Zu den physiologischen Funktionen der NOS-Isoformen gehören:
nNOS: Verstärkung der synaptischen Plastizität, zentrale Blutdruckregulation (Zentralnervensystem), atypischer Neurotransmitter, Darmperistaltik (Entspannung), Gefäßerweiterung und Peniserektion (Peripheres Nervensystem)
iNOS: Zelluläre Immunabwehr, Vermittlung von Entzündungsreaktionen, Vermittlung der Vasodilatation und des Blutdruckabfalls beim septischen Schock
eNOS: Vasodilatation, Hemmung der Thrombozytenaggregation und -adhäsion an der Gefäßwand, Schutz vor Atherogenese und Atherosklerose
Da NO• nicht stabil ist und innerhalb weniger Sekunden durch Reaktion mit Sauerstoff zu inaktivem Stickstoffdioxid umgesetzt wird, hält die Wirkung nur wenige Sekunden an. Eine Ausnahme bildet die iNOS. Nach Aktivierung kann sie über Tage, Wochen und sogar Jahre hinweg Stickstoffmonoxid produzieren und so pathophysiologische Prozesse in Gang setzen [16*].
Nitrosativer Stress
Als freies Radikal hat NO• potenziell toxische Effekte. Bilden die Zellen dauerhaft zu viel Stickstoffmonoxid, spricht man von Nitrosativem Stress.
Dabei kommt es zur Nitrosierung körpereigener Proteine und Makromoleküle, die hierdurch ihre Funktion verlieren und entzündungsfördernd wirken. Besonders empfindlich gegen oxidative Angriffe sind die Aminosäuren Cystein, Tyrosin, Tryptophan und Histidin [17]. Mit Thiol-haltigen Proteinen bildet NO• sogenannte Nitroso-Thiole. Sie können NO• in allen Organen wieder abgeben und erhöhen seine Halbwertszeit auf etwa 40 Minuten [16*].
Mit Metallen wie Cobalt, Eisen, Kupfer und Mangan geht NO• eine reversible Verbindung ein und blockiert Enzyme und bioaktive Moleküle, die diese enthalten. Eine Auswahl blockierter Moleküle und Enzyme zeigt die Tabelle [16*]:
| Metall | blockiertes Molekül/Enzym | Auswirkung |
|---|---|---|
| Cobalt | Vitamin B12 | B12-Mangel |
| Eisen | Enzymkomplexe I, II und III der Atmungskette |
verringerte ATP-Bildung ⇒ Energiemangel |
| Eisen | Aconitase (Citratzyklus) | Blockade Citratzyklus ⇒ schlechte Kohlenhydratverwertung, ATP-Mangel |
| Eisen | Ferrochelatase | gestörte Häm-Synthese ⇒ Ferritinanstieg, Anämie, Hämopyrrollaktamurie (HPU) |
| Eisen | Katalase | verringerter H2O2-Abbau ⇒ vermehrter oxidativer Stress |
| Kupfer | Superoxid-Dismutase 1 | veringerter O2–•-Abbau ⇒ vermehrter oxidativer Stress |
| Kupfer | Diaminoxidase | gestörter Histaminabbau ⇒ Histaminintoleranz |
| Mangan | Superoxid-Dismutase 2 | veringerter O2–•-Abbau ⇒ vermehrter oxidativer Stress |
Ein hoher Sauerstoffpartialdruck im Blut macht die Bindung rückgängig. Menschen mit Nitrostress fühlen sich deshalb an der frischen Luft deutlich besser als in geschlossenen Räumen (“Frischluftfanatiker”).
Die schwerwiegenste Form von Nitrostress entsteht durch die Reaktion von NO• mit dem Sauerstoffradikal Superoxid (O2–•). Zusammen bilden sie das hochaggressive Superradikal Peroxinitrit:
NO• + O2–• ⟶ ONOO–•
Normalerweise sind weder O2–• noch NO• besonders toxisch, da effiziente Systeme ihre Akkumulation verhindern: O2–• wird durch Superoxid-Dismutase abgebaut, während NO• schnell wegdiffundiert. Unter proinflammatorischen Bedingungen können jedoch erhebliche Mengen an ONOO–• entstehen (Bild unten).
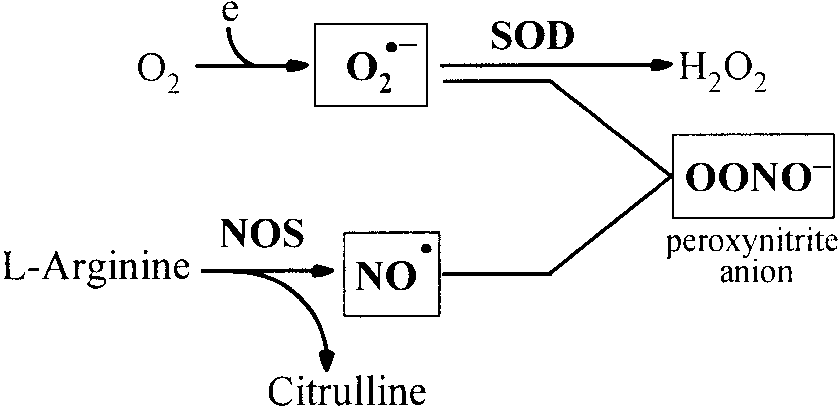
Peroxinitrit ist ein starkes Oxidans, das sämtliche Proteine, die DNA und die Lipidmembranen der Zellen angreift. Über die Aktivierung des Transkriptionsfaktors NF-κB wirkt es stark entzündungsfördernd. Anders als NO• bindet ONOO–• irreversibel an Metalle und führt zu massiven Störungen im Zellstoffwechsel und Funktionsverlusten von Gewebe. Ist die Energieproduktion in den Mitochondrien gestört, steigt wiederum die Produktion von Superoxid. Diese Wechselwirkung führt in einen Teufelskreis, der als NO•/ONOO−•-Zyklus bezeichnet wird.
Der NO•/ONOO•-Zyklus
Es handelt sich um einen primär lokal ablaufenden biochemischen Teufelskreis aus über 30 Einzelmechanismen, in dessen Zentrum die Reaktion von Stickstoffmonoxid und Superoxid zu Peroxinitrit steht. Der NO•/ONOO•-Zyklus wird in diesem Artikel von Martin L. Pall detailliert beschrieben. Er beinhaltet unter anderem die nachfolgenden Prozesse [16*,19]:
- NO• blockiert die eisenhaltigen Enzyme der Enzymkomplexe I, II und III und den Elektronentransporter Cytochrom c des Enzymkomplex IV der Atmungskette. Die ATP-Produktion sinkt, die O2–•-Produktion steigt.
- NO• oxidiert den Radikalfänger Glutathion, der oxidative Stress steigt.
- Stickstoffmonoxid und Superoxid (O2–•) reagieren zu Peroxinitrit (ONOO-•). ONOO-• bindet irreversibel an Metalle und blockiert alle entsprechenden Enzyme. Die ATP-Produktion bricht ein.
- Peroxinitrit oxidiert Tetrahydrobiopterin, was zu einer BH4-Verarmung führt. Die Folge ist eine (partielle) NOS-Entkopplung [20]. Die NO-Synthase produziert jetzt neben NO• auch O2–•, beide reagieren zu ONOO-•.
- Peroxinitrit nitriert Glutathion, der antioxidative Schutz und die Entgiftungsfähigkeit des Körpers nehmen ab.
- Peroxinitrit aktivert den Transkriptionsfaktor NF-κB. NF-κB stimuliert die Transkription pro-inflammatorischer Zytokine wie IL-1b, IL-6, IL-8, TNF-α und IFN-γ. Diese stimulieren wiederum die iNOS in den Immunzellen.
- In Neuronen steigern ONOO-• und ATP-Mangel die Sensibilität der NMDA-Rezeptoren. Kalzium strömt in die Zellen. Intrazelluläres Kalzium stimuliert die nNOS, mtNOS und die eNOS, die kalziumabhängig aktiviert werden.
Auslöser des Zyklus können kurzfristige Stressoren wie Infektionen, Entzündungen, Impfungen, exzessive körperliche Belastungen oder Sauerstoffmangel sein. Über die Aktivierung der iNOS steigen die NO•-Werte in kurzer Zeit bis auf das 100-fache der normalen Belastung an. Begleiterscheinungen wie oxidativer Stress regen weitere Elemente des Zyklus an.
Eine bedeutsame Quelle von Nitrostress sind chronisch inflammatorische Prozesse. Über NF-kB-stimulierte Zytokine wird der Organismus mit NO• überlastet. Sogenannte “Stille Entzündungen” entstehen zum Beispiel im Bauchfett, bei Parodontose, Vitaminmangel (B6, B12, Folat), Rauchen, Medikamenteneinnahme oder durch Belastung mit Umweltschadstoffen [16*,19].
Assoziierte Krankheiten
Die Lebensdauer von Superoxid ist extrem kurz. In hohen Konzentrationen reagiert es mit sich selbst in weniger als 50 ms zu Wasserstoffperoxid [16*]. Der NO•/ONOO•-Zyklus ist deshalb auf Gewebe mit starker O2–•-Produktion begrenzt und verursacht eine große Bandbreite an lokalen Symptomen.
Der NO•/ONOO•-Zyklus wird unter anderem mit den nachfolgenden autoimmunen und neurologischen Erkrankungen in Verbindung gebracht: Tinnitus, Asthma, Multiple Sklerose, Silikonimplantat-assoziiertes Syndrom, Amyotrophe Lateralsklerose, Morbus Parkinson und Morbus Alzheimer. Diese Krankheiten unterscheiden sich in erster Linie durch die betroffene Körperregion [19].
Durch die Verarmung an Antioxidantien und die Wirkung proinflammatorischer Zytokine kommt es darüber hinaus auch zu systemischen Effekten. So wurde die Beteiligung des Zyklus an der Entstehung des chronischen Erschöpfungssyndroms, der multiplen Chemikaliensensibilität, der Fibromyalgie und der posttraumatischen Belastungsstörung in Tiermodellen belegt [19].
L-Arginin als Nahrungsergänzung – Nützlich, sinnlos oder gefährlich?
L-Arginin ist das Substrat für die Produktion von NO• über die NO-Synthase. Sie ist eine bedingt essentielle Aminosäure, das heißt der Körper nimmt sie mit der Nahrung auf, kann sie aber auch selbst herstellen. Nennenswerte Mengen an L-Arginin sind in Fleisch, Fisch, Hülsenfrüchten, Haferflocken und Buchweizen enthalten. L-Arginin wird im Harnstoffzyklus in einem mehrstufigen Prozess aus den Aminosäuren L-Ornithin und L-Aspartat gebildet (Bild unten).
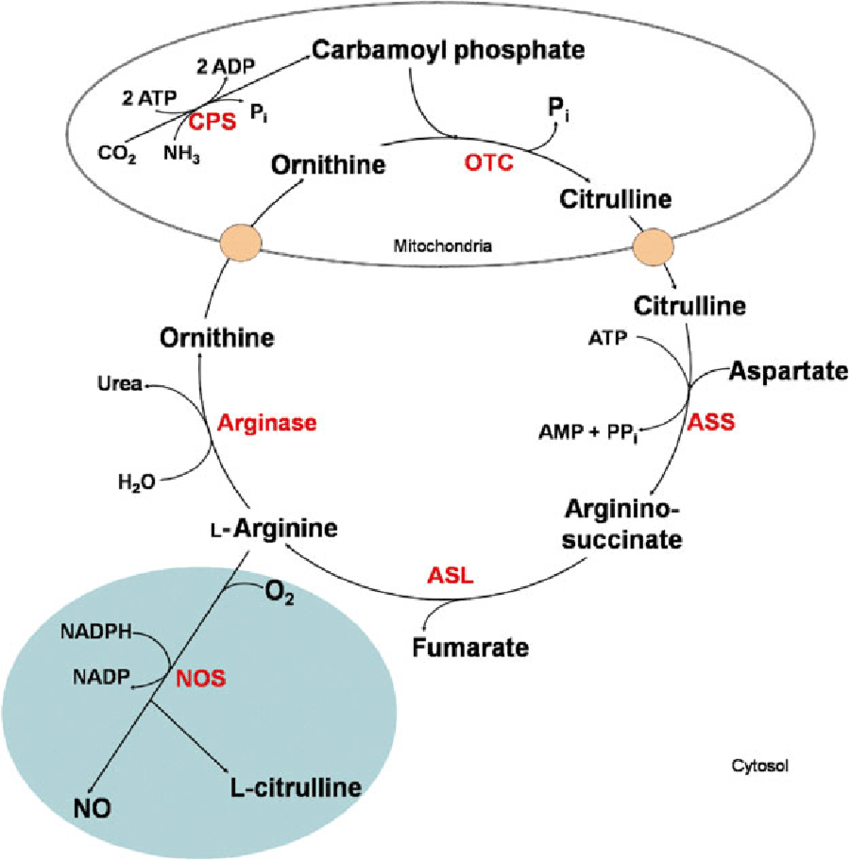
L-Arginin-Mangel
Weil L-Arginin für die Ausschüttung anaboler Hormone wie Wachstumshormon, Insulin und Insulin-like Growth Factor benötigt wird, kann in Wachstumsphasen, bei Schwangerschaft, Verletzungen oder Krankheit ein Arginin-Defizit entstehen.
Fehlt L-Arginin als Substrat der NO-Synthase, produzieren die Endothelzellen weniger NO•. Eine verringerte NO•-Verfügbarkeit ist mit der Entwicklung von Bluthochdruck, Atherosklerose und Thrombose (NO• hemmt die Thrombozytenaggregation) assoziiert [22]. Zudem weisen Personen mit Atherosklerose-Risikofaktoren wie Hypercholesterinämie, Bluthochdruck, Diabetes mellitus, Nierenversagen, Hyperhomocysteinämie und Rauchen hohe Plasmaspiegel von asymmetrischem Dimethylarginin (ADMA) auf [23]. ADMA ist ein körpereigenes L-Arginin-Derivat, das hemmend auf die NOS wirkt und die NO•-Produktion zusätzlich herabsetzt. Ein L-Arginin-Mangel und ein Anstieg des eNOS-Inhibitors ADMA führen zur Entkopplung der eNOS [24].
Die Gabe von L-Arginin kann die ADMA-Bildung zurückdrängen und das Risiko kardiovaskulärer Erkrankungen senken. L-Arginin scheint vor allem bei Menschen mit hohen AMDA-Spiegeln eine gute Wirkung zu haben. Dabei muss auch auf eine ausreichende Versorgung mit dem Cofaktor BH4 geachtet werden. Bei einem BH4-Mangel besteht die eNOS-Entkopplung fort [22].
L-Arginin im Sport
Viele Hersteller L-Arginin-haltiger Nahrungsergänzungsmittel werben mit einer stärkeren Durchblutung der Muskulatur durch die Aktivierung der NO-Synthase. Die bessere Sauerstoff- und Nährstoffversorgung soll die sportliche Leistungsfähigkeit steigern und – über die Stimulation von Wachstumshormon – die Proteinsynthese und Muskelerholung nach dem Training verbessern.
Allerdings konnte in verschiedenen Studien bei gesunden Personen nach der Einahme von 6 bis 10 Gramm L-Arginin pro Tag kein signifikanter Anstieg der NO•-Produktion nachgewiesen werden. Demzufolge scheint eine L-Arginin-Supplementierung bei ausgewogender Ernährung und physiologischen ADMA-Konzentrationen keinen nennenswerten Einfluss auf die Enzymaktivität der NOS zu haben. Stattdessen scheint ein Sättigungseffekt einzutreten [23].
Wegen ihrer schlechten Qualität sind viele Studien zu L-Arginin jedoch nur bedingt aussagekräftig. So betrug die Studiendauer in einigen Fällen weniger als zwei Wochen, die Ernährung der Teilnehmer wurde nicht kontrolliert und/oder es handelte sich nicht um kontrollierte Doppelblindstudien mit L-Arginin- und Placebo-Gabe. Für experimentierfreudige Gesunde könnte es sich also lohnen, L-Arginin auszuprobieren und auf das eigene Körpergefühl zu achten.
Risiken der Supplementierung
Einige Quellen, darunter der Mitochondrien-Spezialist Dr. Kuklinski, warnen vor nitrosativem Stress durch die längerfristige Einnahme von L-Arginin. Dagegen betonen Wissenschaftler wie Dr. Poeggeler, dass L-Arginin die Entkopplung der NOS verhindert und so gegen Nitrostress schützt [25]. Tatsächlich ist die Studienlage zu den Auswirkungen einer langfristigen L-Arginin-Supplementierung nicht eindeutig [26]. Wie so oft in der Biochemie scheint es auf die Mikroumgebung und die Faktoren, die auf eine Zelle einwirken, anzukommen.
Für gesunde Menschen ist die Einnahme von bis zu 20 Gramm L-Arginin pro Tag sehr wahrscheinlich ohne Risiko und sogar vorteilhaft (Wachstum, Sport). Vorsicht ist dagegen geboten bei Anzeichen von oxidativem und/oder nitrosativem Stress: Ist der NO•/ONOO•-Zyklus einmal in Gang, kann der BH4-Mangel eine NOS-Entkopplung auslösen. L-Arginin kann die Superoxid-Produktion dann anheizen anstatt sie zu hemmen. In einer Studie mit arthritiskranken Ratten führte die Gabe von L-Arginin zur Überproduktion von Superoxid in der Aorta [24].
Im Zweifelsfall kann man die eigene Nitrostressbelastung messen lassen. Ein zuverlässiger Marker ist Nitrotyrosin im Blut. Es entsteht bei der Reaktion von Peroxinitrit mit der Aminosäure Tyrosin. Außerdem empfiehlt sich die Einnahme von Mikronährstoffen, die den NO•/ONOO•-Zyklus dämpfen. Zu ihnen gehören Glutathion, Cystein, Magnesium, Vitamin B12 (als Hydroxocobalamin), Folat (als 5-Methyltetrahydrofolat), Coenzym Q10 (als Ubichinol), Selen und Zink [27].
Stickstoffmonoxid und Histamin
Wer an Histaminintoleranz oder Mastzellaktivierungssyndrom (MCAS) leidet, kennt es vermutlich: Die Haut ist gerötet (Flush), der Kopf schmerzt. Der Grund: Histamin dockt an die Histaminrezeptoren in den Blutgefäßen an, wo es die eNOS stimuliert und NO• die Gefäße weitstellt. Sind die Arterien der Hirnhäute betroffen, entsteht der Histamin-typische vaskuläre Kopfschmerz [28].
Histamin und Stickstoffmonoxid sind eng miteinander verknüpft, denn Mastzellen schütten nicht nur Histamin und andere proinflammatorische Botenstoffe aus, sondern exprimieren zusätzlich die iNOS. Deshalb leiden Menschen mit MCAS eher an Nitrostress als solche mit normalen Mastzellen. Häufige Begleiterscheinungen von MCAS sind extreme Müdigkeit, Nerven- und/oder Gelenkschmerzen – Symptome, die eine Beteiligung des NO•/ONOO•-Zyklus nahelegen.
Weil ich selbst von MCAS betroffen bin, nehme ich kein L-Arginin ein. Zwar gibt es keinen Beweis, dass eine L-Arginin-Supplementierung die Expression der iNOS verstärkt, ich möchte hier aber kein Risiko eingehen. Eine erhöhte Verfügbarkeit von Arginin scheint zudem immunmodulierend zu wirken. Die Auswirkungen dieser Modulation sind Gegenstand aktueller Forschung [29].
Um die positiven Effekte von NO• beim Sport für mich zu nutzen, achte ich darauf, möglichst nur über die Nase einzuatmen. Das von der Nasenschleimhaut produzierte NO• stellt die Bronchien und Gefäße weit und verbessert die Sauerstoffversorgung. Am Anfang war es ungewohnt, aber mittlerweile möchte ich nicht mehr auf das bewusste Atmen verzichten.
Hast Du andere Tipps oder hast Du Erfahrungen mit der Einnahme von L-Arginin gemacht? Ich freue mich über Kommentare.
* Als Amazon-Partner verdiene ich an qualifizierten Verkäufen
Quellen
- https://flexikon.doccheck.com/de/NO-Synthase
- https://de.wikipedia.org/wiki/Stickstoffmonoxid
- Aquilano, Katia & Baldelli, Sara & Rotilio, Giuseppe & Ciriolo, Maria. (2008). Role of Nitric Oxide Synthases in Parkinson’s Disease: A Review on the Antioxidant and Anti-inflammatory Activity of Polyphenols. Neurochemical Research. 33. 2416-2426
- Durán WN, Breslin JW, Sánchez FA. The NO cascade, eNOS location, and microvascular permeability. Cardiovasc Res. 2010;87(2):254-261
- Zhu, Jinqiang & Song, Wanshan & Li, Lin & Fan, Xiang. (2016). Endothelial nitric oxide synthase: A potential therapeutic target for cerebrovascular diseases. Molecular Brain. 9(1)
- Yingzi Zhao, Paul M. Vanhoutte, Susan W.S. Leung. Vascular nitric oxide: Beyond eNOS. Journal of Pharmacological Sciences. Volume 129; Issue 2; 2015; Pages 83-94; ISSN 1347-8613
- https://de.wikipedia.org/wiki/Nitroglycerin
- Esplugues JV. NO as a signalling molecule in the nervous system. Br J Pharmacol. 2002;135(5):1079-1095
- Costa ED, Rezende BA, Cortes SF, Lemos VS. Neuronal Nitric Oxide Synthase in Vascular Physiology and Diseases. Frontiers in Physiology. 2016;7:206
- Jamaati H, Mortaz E, Pajouhi Z, Folkerts G, Movassaghi M, Moloudizargari M, Adcock IM and Garssen J (2017) Nitric Oxide in the Pathogenesis and Treatment of Tuberculosis. Front. Microbiol. 8:2008
- Rowe A, Farrell AM, Bunker CB. Constitutive endothelial and inducible nitric oxide synthase in inflammatory dermatoses. Br J Dermatol. 1997 Jan;136(1):18-23
- Gokhale NR, Belgaumkar VA, Pandit DP, Deshpande S, Damle DK. A study of serum nitric oxide levels in psoriasis. Indian J Dermatol Venereol Leprol 2005;71:175-8
- Weller R, Pattullo S, Smith L, Golden M, Ormerod A, Benjamin N. Nitric oxide is generated on the skin surface by reduction of sweat nitrate. J Invest Dermatol. 1996 Sep;107(3):327-31
- Weitzberg E, Lundberg JO. Nonenzymatic nitric oxide production in humans. Nitric Oxide. 1998;2(1):1-7
- Förstermann U, Sessa WC. Nitric oxide synthases: regulation and function. Eur Heart J. 2012;33(7):829-837d
- Dr. sc. med. Kuklinski J. Mitochondrien: Symptome, Diagnose und Therapie, Herausgeber: Aurum in Kamphausen Media GmbH. Auflage: 3 (2018) Buch*
- Novo E, Parola M. Redox mechanisms in hepatic chronic wound healing and fibrogenesis. Fibrogenesis Tissue Repair. 2008 Oct 13;1(1):5
- Moulian, Nathalie & Truffault, Frédérique & Gaudry-Talarmain, Yvette & Serraf, Alain & Berrih-Aknin, Sonia. (2001). In vivo and in vitro apoptosis of human thymocytes are associated with nitrotyrosine formation. Blood. 97. 3521-30
- Pall ML. Teufelskreis NO/ONOO−-Zyklus, oxidativer Stress, mitochondriale, inflammatorische und neurologische Dysfunktion. umwelt·medizin·gesellschaft 4/2010(23):281-293
- Verena Gebhart, Katja Reiß, Alexander Kollau, Bernd Mayer, Antonius C.F. Gorren. Site and mechanism of uncoupling of nitric-oxide synthase: Uncoupling by monomerization and other misconceptions, Nitric Oxide, Volume 89, 2019, Pages 14-21, ISSN 1089-8603
- Pons, Antoni & Bescós, Raúl & Sureda, Antoni & Tur, Josep A. (2017). Metabolic Precursors of l-Arginine Supplementation in Sports: A Focus on l-Citrulline and l-Ornithine. 10.1007/978-3-319-26009-9_24
- Puca AA, Carrizzo A, Ferrario A, Villa F, Vecchione C. Endothelial nitric oxide synthase, vascular integrity and human exceptional longevity. Immun Ageing. 2012;9(1):26. Published 2012 Nov 15
- Alvares, T.S., Conte-Junior, C.A., Silva, J.T. et al. Acute L-Arginine supplementation does not increase nitric oxide production in healthy subjects. Nutr Metab (Lond) 9, 54 (2012)
- Anna Łuczak, Marta Madej, Agata Kasprzyk, Adrian Doroszko, “Role of the eNOS Uncoupling and the Nitric Oxide Metabolic Pathway in the Pathogenesis of Autoimmune Rheumatic Diseases”, Oxidative Medicine and Cellular Longevity, vol. 2020, Article ID 1417981, 15 pages, 2020
- Nitrosativen Stress durch L-Arginin ausschalten, Weinberg, Poeggeler, Vogepohl, CoMed, Oktober 2012
- Huang J, Ladeiras D, Yu Y, Ming X-F and Yang Z (2021) Detrimental Effects of Chronic L-Arginine Rich Food on Aging Kidney. Front. Pharmacol. 11:582155
- Martin L. Pall. Wie heilt man Erkrankungen mit Beteiligung des NO/ONOO –-Zyklus?
- https://www.netdoktor.de/krankheiten/histaminintoleranz/
- Rath M, Müller I, Kropf P, Closs EI and Munder M (2014) Metabolism via arginase or nitric oxide synthase: two competing arginine pathways in macrophages. Front. Immunol. 5:532









Comments powered by Talkyard.