Teilen auf
Twitter Facebook LinkedIn WhatsAppEssen sollte uns im Idealfall nicht nur schmecken, sondern uns auch mit allen Nährstoffen versorgen, die der Körper braucht, um uns gesund und leistungsfähig zu erhalten. Leider nehmen wir beim Essen und Trinken nicht nur hochwertige Makro- und Mikronährstoffe, sondern auch jede Menge Zusatzstoffe, Keime, Erreger, Umweltgifte, Medikamentenrückstände oder Mikroplastik in uns auf.
Der Darm steht vor der großen Herausforderung, das Körperinnere gegen schädliche Eindringlinge aus der Umwelt schützen zu müssen und gleichzeitig Einfachzucker, Aminosäuren, Fette, Vitamine, Mineralien und Wasser zu resorbieren. Dies gelingt ihm über eine ausgeklügelte Kombination ineinander verzahnter Schutzebenen, die zusammen die Darmbarriere bilden.
Die Darmbarriere
Als Darmbarriere bezeichnet man die Fähigkeit des Darms, schädliche Stoffe wie Krankheitserreger, Nahrungsgifte oder pathogene Bakterien vom Eindringen in den Körper abzuhalten. Dieser Schutzwall ist – ähnlich einer Zwiebel – aus mehreren Schichten aufgebaut, die jede für sich eine Barriere zur Abwehr von Pathogenen darstellt. Einen Teil dieser Schichten von ihnen hast Du schon im Artikel Das unterschätzte Organ kennengelernt. Solange die innerste Schicht intakt ist, sind auch die darauf folgenden intakt. Fällt allerdings die erste Barriere, dann ist es nur eine Frage der Zeit, bis die nächste Barriere angegriffen wird.
1: Das Mikrobiom
Das Mikrobiom ist der innerste chemische und mikrobielle Schutzwall des Darms. Eine gesunde Darmlora aus überwiegend säurebildenden Laktobazillen und Bifidobakterien sorgt für niedrige pH-Werte im Darm und tötet schädliche Mikroorganismen, die in dem sauren Milieu nicht überleben können. Im Darm findet also eine Art Säuresterilisation statt. Daneben haben milchsaure Bakterien die Eigenschaft, sich an die Darmschleimhaut anzuheften und so die Vermehrung von pathogenen Keimen und Kranheitserregern zu blockieren.
Die protektive Säuerungsflora hemmt zudem proinflammatorische Zytokine und stimuliert die Ausschüttung antiinflammatorischer Zytokine. Beispielsweise regulieren nicht-pathogene Clostridiumspezies und Faecalibacterium prausnitzii das Immunsystem, indem sie überschießenden Immunreaktionen entgegenwirken und so die Entstehung von Autoimmunkrankheiten verhindern [1]. Wissenschaftliche Untersuchungen zeigen, dass eine große Bakterienvielfalt im Darm besonders widerstandsfähig gegenüber Störfaktoren von außen ist und mit einem besseren Gesundheitszustand korreliert [2].
2: Die Verdauungsenzyme
Die zweite Barriere bilden die nahrungsspaltenden Enyme wie Peptidasen, Lipasen und Disaccharidasen, die von den Zellen des Darmepithels gebildet werden. Sie zerlegen die mit der Nahrung aufgenommenen Eiweiße, Fette und Kohlenhydrate in Aminosäuren, Fettsäuren und Einfachzucker. Diese kleinsten Nahrungsbausteine können die Epithelzellen der Darmschleimhaut passieren und werden von dort aus ins Blut (Aminosäuren, Einfachzucker, kurz- und mittelkettige Fettsäuren) oder in die Lymphe (langkettige Fettsäuren) geschleust [3]. Die Verdauungsenzyme verhindern also, dass große Moleküle wie unverdaute Eiweißbruchstücke die Darmschleimhaut erreichen und dort zu Irritationen führen.
3: Der Mukus
Die Becherzellen der Darmschleimhaut (siehe Epithel) sondern einen zähflüssigen Schleim ab, der an den Epithelzellen haftet und die dritte, mechanische Schutzebene des Darms bildet. In diesem Schleim leben vor allem Bakterien, die die im Schleim enthaltenen Polysaccharide enzymatisch abbauen und für ihren eigenen Stoffwechsel nutzbar machen können. Zu ihnen gehören zum Beispiel Bakterien der Spezies Akkermansia muciniphila und Bacteroides thetaiotaomicron. Die dabei entstehenden Oligosaccharide dienen wiederum den Butyrat-produzierenden Faecalibacterium prausnitzii als Nahrung.
Der resultierende Biofilm aus Schleim, Bakterien und Nährstoffen schützt das Darmepithel also nicht nur vor mechanischen und chemischen Einwirkungen aus dem Darmlumen, sondern versorgt die Zellen gleichzeitig mit Energie. Eine gut ernährte Darmschleimhaut bildet eine Barriere gegen Eindringlinge und gewährleistet gleichzeitig einen selektiven Stofftransport. Chronisch-entzündliche Darmerkrankungen wie Colitis Ulzerosa zeichnen sich oft durch eine reduzierte Mukusschicht aus [4].
4: Immunglobulin A und Mannose-bindendes Lektin
Die vierte Schutzebene des Darms bilden Immunglobulin A (IgA) und das Mannose-bindende Lektin (MBL).
Immunglobuline sind die Antikörper des spezifischen Immunsystems. Etwa 15 % aller Antikörper im menschlichen Blutserum sind IgA-Antikörper. Des Weiteren ist IgA in den Sekreten des Magen-Darm-Trakts, der Vagina, im Nasen- und Bronchialsekret, in der Tränenflüssigkeit und sogar in Muttermilch enthalten [5]. Es wird von den B-Lymphozyten (Plasmazellen) im Darm produziert (sekretorisches IgA) und ist für die Abwehr von Erregern an der Schleimhautoberfläche zuständig.
Das Mannose-bindende Lektin gehört zu den wichtigsten Komponenten der angeborenen Immunabwehr. Es bindet sich an die Oberfläche von Krankheitserregern und Pilzen und markiert diese für die Elimination durch Abwehrzellen des unspezifischen Immunsystems. MBL wird hauptsächlich von der Leber produziert und ins Blut ausgeschüttet. Auch die Epithelzellen der Darmschleimhaut produzieren MBL zur Abwehr von Candida albicans [6].
5 bis 10% aller Menschen haben einen genetisch bedingten MBL-Mangel [7]. Die Folge ist eine erhöhte Anfälligkeit für Candida-Infektionen und bakterielle Infekte (Pneumokokken-Infekte, chronische Atemwegsinfekte, Nasen-Nebenhöhlen-Infekte) und Mittelohrentzündung bei Kleinkindern.
5: Das Epithel
Die fünfte Barriere ist das Darmepithel (Lamina epithelialis). Es besteht aus einer einzigen Zellschicht, die aus sechs verschiedenen Zelltypen aufgebaut ist:
- Enterozyten (Saumzellen) bilden die zahlenmäßig größte Zellgruppe. Ihre Mikrovilli vergrößern die innere Oberfläche des Dünndarms, sekretieren Verdauungsenzympe und absorbieren Einfachzucker, Fettsäuren, Aminosäuren, Vitamine und Mineralstoffe.
- Becherzellen sind einzellige Drüsen zwischen den Epithelzellen, die einen durchsichtigen Schleim produzieren. Letzterer enthält sogenannte visköse Muzine, die aus Glykoproteinen (Proteine mit kurzen Kohlenhydratketten) bestehen und bestimmten Bakterien als Nahrung dienen (siehe Mukus). Becherzellen sind im gesamten Darm, aber vor allem im Dickdarm sehr reichlich vorhanden.
- Enteroendokrine Zellen sezernieren Hormone und Neurotransmitter wie Cholezystokinin, Sekretin oder Serotonin. Ein Teil der enteroendokrinen Zellen ist über Synapsen direkt mit dem Vagusnerv verknüpft. Diese als Neuropods bezeichneten Zellen leiten Signale innerhalb von Millisekunden vom Darm ins Gehirn [8].
- Panethzellen befinden sich auf dem Grund der Dünndarmkrypten, wo sie antibakteriell wirkende Lysozyme, Peptidasen, Laktoferrine und Defensine ausschütten. Panethzellen gehören zum unspezifischen Immunsystem und schütten bei Patienten mit Reizdarm oder aktiver Colitis Ulcerosa große Mengen des antimikrobiellen Peptids Beta-Defensin 2 aus [9].
- M-Zellen sind membranöse Zellen über den sogenannten Peyer-Plaques. Sie transportieren Antigene in das darunterliegende, darmassoziierte lymphatische Gewebe (GALT) und ermöglichen so die Produktion von spezifischen Antikörpern. Daher gehören M-Zellen zum spezifischen Immunsystem. M-Zellen finden sich in großer Zahl im hinteren Teil des Dünndarms (Ileum) und im Wurmfortsatz.
- Multipotente Stammzellen in den Lieberkühn-Krypten sorgen dafür, dass sich das gesamte Darmepithel innerhalb von drei bis fünf Tagen vollständig erneuert [10] (siehe Abbildung unten). Um die hohe Regenerationsrate aufrechtzuerhalten, benötigen die Zellen ausreichend Nahrung in Form von Butyrat. Im Fall einer Invasion durch pathogene Bakterien produzieren die intestinalen Stammzellen außerdem den Entzündungsmediator Interleukin-8 [11].
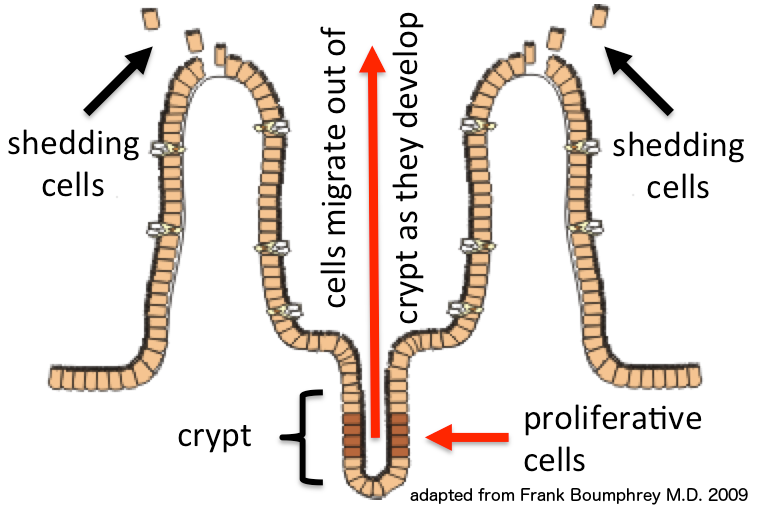
6: Tight Junctions
Die Zellen des Epithels sind durch ein Netzwerk von Membranproteinen miteinander verbunden. Diese als Tight Junctions bezeichneten Proteine bilden die sechste, physikalische Barriere des Darms.
Für die Aufnahme von Stoffen aus dem Darmlumen in die Blutbahn gibt es zwei mögliche Transportwege:
-
Beim transzellulären Transport werden Stoffe mithilfe spezieller Transportmoleküle durch die Epithelzellen hindurch geschleust. Aminosäuren, Glukose, kurzkettige Fettsäuren und bestimmte Elektrolyte werden auf diese Weise von der Darmschleimhaut resorbiert.
-
Beim parazellulären Transport passieren Stoffe das Epithel über die Zellzwischenräume. Über die parazellulären Kanäle werden hauptsächlich Wasser und in Wasser gelöste Stoffe mit Molekülradien von bis zu 4,5 Å (1 Å = 10-7 mm) transportiert [12] (vgl. Abbildung unten).
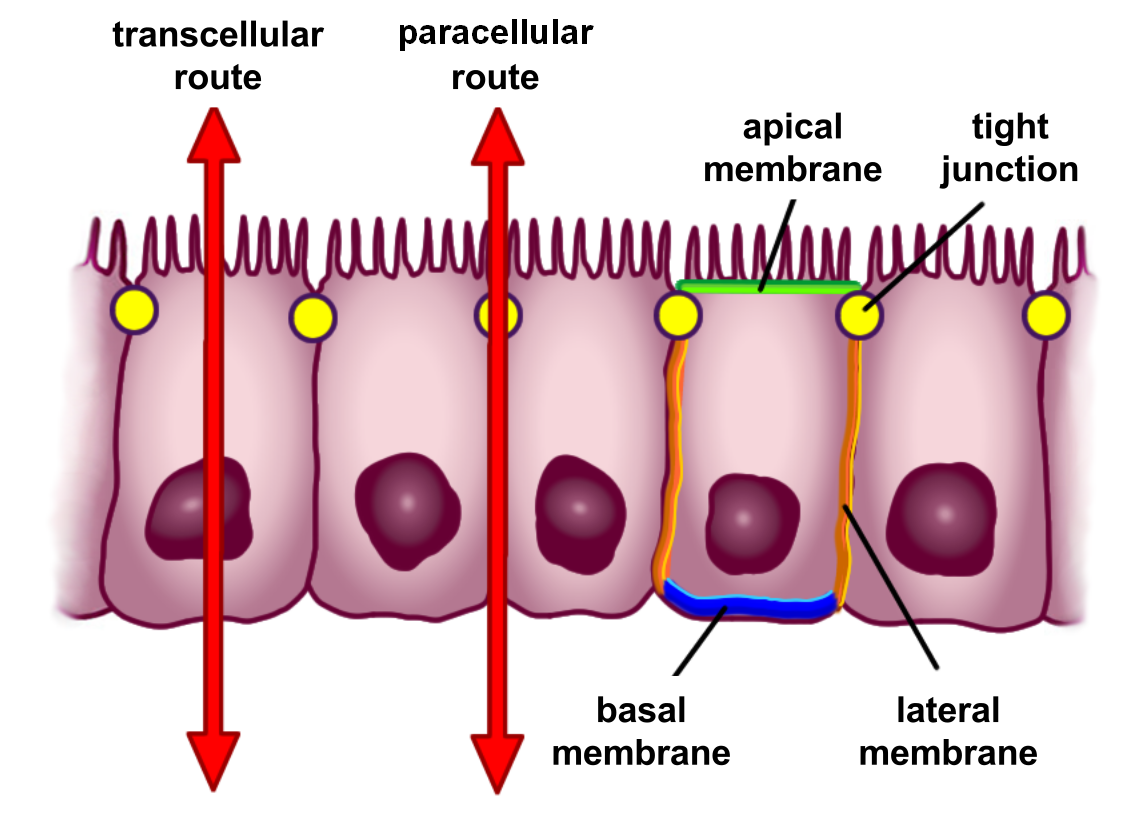
Über die Tight Junctions können die parazellulären Kanäle enger oder weiter gestellt werden. Auf diese Weise schützen sie das interne interzelluläre Milieu des Darms vor dem ungeregelten Eindringen externer Substanzen. In durchlässigen Epithelien wie dem Darm passieren bis zu 90 % der Stoffe die Grenzschicht über den Zwischenzellraum, in dichten Epithelien wie der Blut-Hirn-Schranke findet dagegen so gut wie kein parazellulärer Transport statt [13].
7: Immunzellen
Wenn Pathogene in die Darmschleimhaut eingedrungen sind, greift die letzte Abwehrreihe des Darms: Die Immunabwehr durch Proteine und phagozytierende Zellen im inneren der Darmwand.
Das Immunsystem besteht aus zwei Komponenten, die einander ergänzen, dem angeborenen (unspezifischen) und dem erworbenen (spezifischen) Immunsystem. Zusätzlich unterscheidet man zwischen der zellulären und der humoralen Abwehr. Die zelluläre Abwehr richtet sich gegen Mikroben und Karzinogene, die in die Zellen der Organgewebe eingedrungen sind. Die humorale Abwehr bekämpft Mikroben, die in die Extrazellulärräume der Organe und Körperflüssigkeiten (Blut, Lymphe) eingedrungen sind (lat. humor = Saft, Flüssigkeit). Die nachfolgende Tabelle zeigt die Gliederung des Immunsystems mit ihren Komponenten [14].
| Komponenten | Unspezifische (angeborene) Abwehr | Spezifische (erworbene) Abwehr |
|---|---|---|
| Zellulär | Monozyten/Makrophagen Granulozyten (eosinophile, basophile, neutrophile) Dendritische Zellen Natürliche Killerzellen Mastzellen |
B-Lymphozyten (B-Zellen) T-Lymphozyten (T-Zellen) |
| Humoral | Komplementsystem Zytokine (z. B. Interleukine, Tumor-Nekrose-Faktor) Enzyme (z. B. Proteasen, Lipasen, Nukleasen) Defensine Sauerstoff und Stickstoff-Radikale |
Antikörper (Immunglobuline) |
B-Lymphozyten produzieren sowohl Antikörper für die zelluläre als auch für die humorale Abwehr. Die meisten Immunglobuline sind T-Zell-abhängig: Um sie produzieren zu können, benötigt die B-Zelle zusätzlich zum Kontakt mit dem eigentlichen Antigen das Signal einer T-Zelle. Erst dann kann sie zu einer Plasmazelle heranreifen und Antikörper produzieren. Die beteiligten T-Lymphozyten werden deshalb auch T-Helferzellen genannt (Abbildung unten).
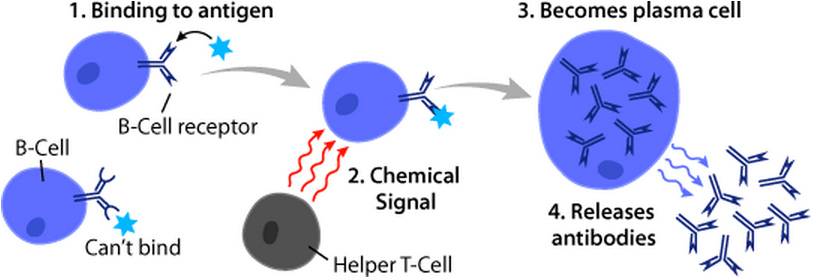
T-Helferzellen werden wiederum in verschiedene Untergruppen eingeteilt. An dieser Stelle gehe ich nur auf die Untergruppen der TH1-Zellen und der TH2-Zellen ein. Die nachstehenden Erläuterungen sind zudem stark vereinfacht.
TH1-Zellen sind vor allem für die zelluläre Abwehr zuständig. Sie bekämpfen Viren sowie intrazelluläre Bakterien und Parasiten. Dabei schalten sie befallene Zellen aus, indem sie entsprechende Fresszellen (Makrophagen) aktivieren. Weil sie Entzündungsprozesse auslösen, gelten TH1-Zellen als pro-inflammatorische Abwehr. Daneben aktivieren TH1-Zellen die Produktion von Immunglobulin IgG2 und IgG3 in den B-Lymphozyten.
TH2-Zellen sind die humorale Abwehr des Körpers. Sie stimulieren B-Zellen zur Herstellung der Immunglobuline IgG1, IgE und IgA, die sich anschließend in Körperflüssigkeiten und Sekreten verteilen. TH2-Zellen wirken gegen extrazelluläre Bakterien, Pilze und Parasiten. Weil sie die TH1-Zellen und deren entzündliche Wirkung unterdrücken, gelten TH2-Zellen als anti-inflammatorische Abwehr.
Im Idealzustand herrscht ein Gleichgewicht zwischen TH1- und TH2-Zellen. Bei vielen Menschen überwiegt jedoch einer der beiden Anteile und es kommt entweder zu einer TH1- oder einer TH2-Dominanz. Dieses Ungleichgewicht äußert sich im Fall einer gestörten Darmbarriere – dem sogenannten Leaky Gut – in unterschiedlichen Symptomen und Krankheitsbildern.
Quellen
- Mathewson ND, Jenq R, Mathew AV, et al.: Gut microbiome derived metabolites modulate intestinal epithelial cell damage and mitigate Graft-versus-Host Disease. Nat Immunol 2016; 17: 505–13
- Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Diversity, stability and resilience of the human gut microbiota. Nature. 2012;489(7415):220‐230.
- https://en.wikipedia.org/wiki/Fatty_acid#Digestion_and_intake
- Pullan RD, Thomas GA, Rhodes M, et al.: Thickness of adherent mucus gel on colonic mucosa in humans and its relevance to colitis. Gut 1994; 35: 353–9.
- https://www.netdoktor.de/laborwerte/immunglobulin/a/
- Choteau, L., Parny, M., François, N. et al. Role of mannose-binding lectin in intestinal homeostasis and fungal elimination. Mucosal Immunol 9, 767–776 (2016).
- https://de.wikipedia.org/wiki/Pneumokokken
- Kaelberer MM, Buchanan KL, Klein ME, et al. A gut-brain neural circuit for nutrient sensory transduction. Science. 2018;361(6408):eaat5236.
- Langhorst, J.; Junge, A.; Rueffer, A.; Wehkamp, J.; Foell, D.; Michalsen, A.; Musial, F.; Dobos, G. J.: Erhöhtes humanes β-Defensin 2 als Indikator für eine Aktivierung des angeborenen Immunsystems bei Patienten mit Reizdarmsyndrom. Z Gastroenterol 2008; 46 - P184
- Barker N. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration. Nat Rev Mol Cell Biol. 2014;15(1):19–33.
- Eckmann L, Kagnoff MF, Fierer J. Epithelial cells secrete the chemokine interleukin-8 in response to bacterial entry. Infect Immun. 1993;61(11):4569‐4574.
- https://en.wikipedia.org/wiki/Intestinal_permeability
- https://de.wikipedia.org/wiki/Parazellulärer_Transport
- Der Allgemeinarzt, Ausg. 10/2012



Comments powered by Talkyard.