Teilen auf
Twitter Facebook LinkedIn WhatsAppMit Anbruch der sonnigen und warmen Jahreszeit geht es wieder los: “Gesundheitsexperten” warnen vor dem ungeschützten Aufenthalt in der Sonne. Aus Angst vor Sonnenbrand und Hautkrebs schmieren sich viele Deutsche täglich Cremes mit Lichtschutzfaktor 30 oder 50 auf Gesicht und Körper.
In der Tat ist der schwarze Hautkrebs – das maligne Melanom – einer der fünf häufigsten Krebsarten in Deutschland [1]. Als besonders gefährdet gelten Menschen mit hellem Hauttyp und vielen Leberflecken. Ihr “Feind”: Die UV-Strahlung der Sonne. So warnt die Arbeitsgemeinschaft der Dermatologischen Prävention e.V. auf Ihrer Webseite: “Nach derzeitigen Erkenntnissen der Wissenschaft existiert kein Schwellenwert für gesundheitlich ungefährliche UV-Strahlung. Daher gilt: Je weniger, desto besser.” Langfristig drohe Hautkrebs. Außerdem kann es laut ADP innerhalb von Sekunden zu Hautschäden, Augenschäden und zu einer Schwächung des Immunsystems kommen [2]!
Die letzte Aussage ergibt keinen Sinn, denn wir brauchen die Sonne, um Vitamin D zu produzieren. Vitamin D verbessert die Immunabwehr [3]. Ein gutes Immunsystem schützt vor Krebs. Statt in Panik auszubrechen, sollte man sich also besser die biologischen Fakten und wissenschaftlichen Belege ansehen.
Wundersubstanz Melanin
Die meisten hellhäutigen Menschen werden in der Sonne mehr oder weniger braun. Das liegt an speziellen Hautzellen, den Melanonzyten. Diese befinden sich am Grund der Epidermis, der obersten der drei Hautschichten. Sie produzieren das Pigment Melanin, das nicht nur für die sommerliche Bräune sorgt, sondern die Haut auch vor Schäden durch UV-Strahlung schützt.
Melanozyten machen etwa 5 bis 10 % der untersten Zellschicht der Epidermis aus. Melanin wird in den Melanosomen – das sind Zellorganellen der Melanozyten – gebildet und gespeichert. Bei Anregung durch UV-Strahlung übertragen Melanozyten die Melanosomen über dentritische Fortsätze auf die über ihnen liegenen Keratinozyten. Hierdurch entsteht die Hautpigmentierung (Bild unten).
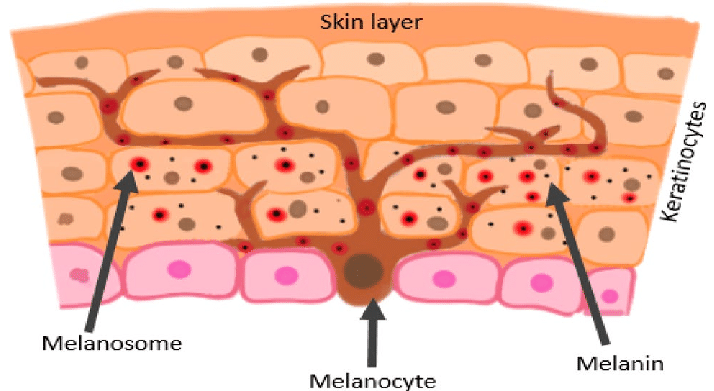
Die individuelle Hautfarbe eines Menschen ergibt sich aus der Anzahl, Größe und Verteilung der Melanosomen in der Epidermis sowie dem Verhältnis von schwarz-dunkelbraunem Eumelanin zu gelb-rötlichem Phäomelanin. Beide Formen werden mithilfe des Enzyms Tyrosinase aus der Aminosäure Tyrosin gebildet, wobei Phäomelanin die schwefelhaltige Aminosäure Cystein enthält (Bild unten).
Dunkelhäutige bilden vor allem Eumelanin und haben mehr und größere Melanosome als Hellhäutige. Dagegen ist der Gehalt an Phäomelanin bei Rothaarigen am höchsten. Menschen mit Albinismus produzieren kein oder sehr wenig Melanin. Häufige Ursache eine genetisch bedingte Störung der Tyrosinase.
Die Melanosome legen sich wie ein chemischer Filter über die Zellkerne der Keratinozyten, wo sie die Zell-DNA gegenüber schädlichen Einflüssen abschirmen [5]. Der Körper bildet Melanin aber nicht nur in der Haut und in den Haarwurzeln, sondern auch im Gehirn, in der Aderhaut des Auges, im Innenohr und in den Schleimhäuten. Denn das Pigment hat protektive physikalische und chemische Eigenschaften.
Sonnenschutz
Melanin wirkt wie ein biologischer Halbleiter, der Licht absorbieren und die aufgenommene Energie als Wärme abstrahlen kann. Sein Absorptionsspektrum ist perfekt abgestimmt auf das Lichtspektrum der Sonne. Wie die untenstehende Graphik zeigt, steigt die Absorptionleistung des Melanins zwischen UV-A- (380 nm – 315 nm) und UV-B-Bereich (315 nm – 280 nm) signifikant an.
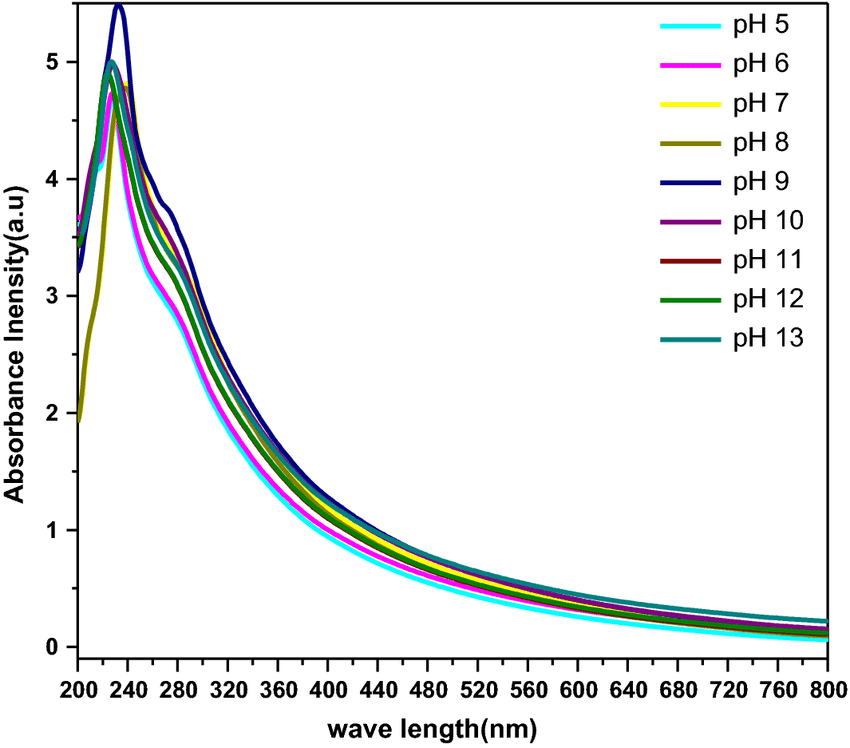
Reaktive Sauerstoffspezies (“Reactive Oxygen Species” – ROS), die bei der Licht-Absorption in den pigmentierten Zellen entstehen, kann Melanin unschädlich machen [7]. Als Radikalfänger hemmt es die UV-induzierte Lipidperoxidation. Die antioxidativen Eigenschaften hängen von der Art des Melanins ab – je größer das Verhältnis von Eumelanin zu Phäomelanin, desto antioxidativer ist das Pigment. Mit Fe3+ komplexiertes Phäomelanin stimuliert die UV-induzierte Lipidperoxidation, Eumelanin dagegen nicht [8].
Entgiftung
Melanin besitzt eine hohe Bindungsaffinität zu Metallionen und organischen Aminen. Es schützt den Körper vor Vergiftungen, indem es Schadstoffe bindet und langsam und in niedriger Konzentration wieder freisetzt. Mit Medikamenten wie Lokalanästhetika, Antibiotika, Benzodiazepinen und Psychopharmaka geht das Pigment reversible und nicht toxische Verbindungen ein. Toxisch ist dagegen der Malaria-Wirkstoff Chloroquin. In Kombination mit Melanin führt er zu Zellschäden wie der Chloroquin-Makulopathie [9, 10].
Chronische Schadstoffbelastungen können die Entgiftungskapazitäten des Melanins erschöpfen und seine chemischen Eigenschaften verändern. Die Melanozyten produzieren dann große Mengen an ROS wie Superoxid und Peroxid, die das pigmentierte Gewebe altern lassen. [10,11*]. Die möglichen Folgen sind:
- Graue Haare durch Schädigung der Melanozyten in den Haarzwiebeln und die Oxidation des melaninbildenden Enzyms Tyrosinase
- Katarakte oder Retinopathie aufgrund der Degeneration der Pigmentschicht der Netzhaut
- Hörverlust aufgrund der Degeneration der Stria vascularis im Innenohr
- Strukturelle Degeneration im Striatum und in der Substantia nigra im Gehirn, die zum Ausbruch der Parkinson-Krankheit führen können
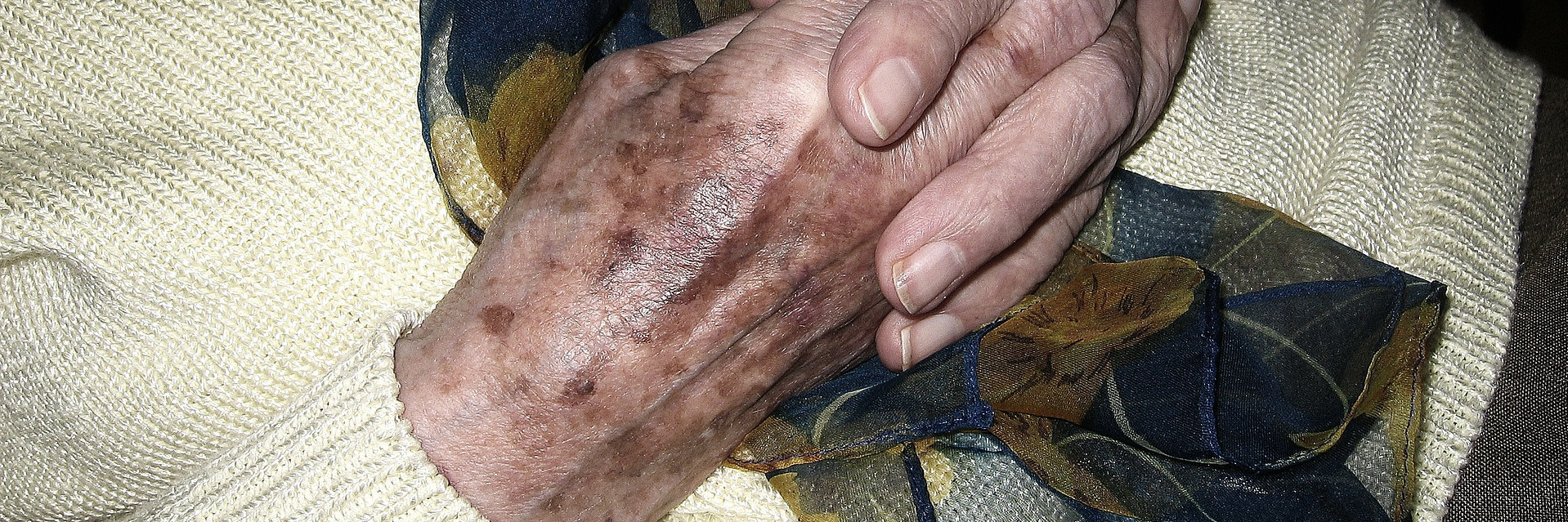
Neben Arzneimitteln können auch Kosmetika, Haushaltschemikalien, Pestizide, Genussgifte, Metalle und UV-Belastung den Melanin-Speicher überlasten [12]. Aufmerksam werden sollte man, wenn sich in kurzer Zeit viele neue Leberflecken bilden. Sie können ein Warnsignal für eine hohe Schadstoffbelastung sein.
Leberflecken
Leberflecken ist die umgangssprachliche Bezeichnung für gutartige, nestartige Ansammlungen von Melanozyten in der Haut. Sie bilden Melanin, das sie aber nicht an die benachbarten Hautzellen abgeben können, weil sie keine Dendriten besitzen. In der Fachsprache werden sie als Nävuszellen oder melanozytäre Nävi bezeichnet. Nävuszellnävi entstehen an der Grenzfläche zwischen Epidermis und Dermis und durchlaufen drei Entwicklungsphasen [13]:
- Junktionsnävus: an der Grenzfläche zwischen Epidermis und Dermis
- Compoundnävus: an der Grenzfläche und in der Dermis
- Dermaler Naevus: rein intradermal
Das Bild unten zeigt vier Typen von Nävi. Fast alle melanozytären Nävi beginnen ihr Leben als Junktionsnävus (2). Mit der Zeit sinken einzelne Zellnester aus der Epidermis in die Dermis ab und verlieren die Fähigkeit zur Melaninsynthese (3). Am Ende geht der Compoundnävus in einen pigmentarmen dermalen Nävus über und wird durch fibröses oder fetthaltiges Gewebe ersetzt (4). Eine Sonderform ist der Blaue Nävus, der aus tiefgelegenen Melanozyten und Makrophagen entsteht und wegen seiner tiefen Lage bläulich erscheint (5).
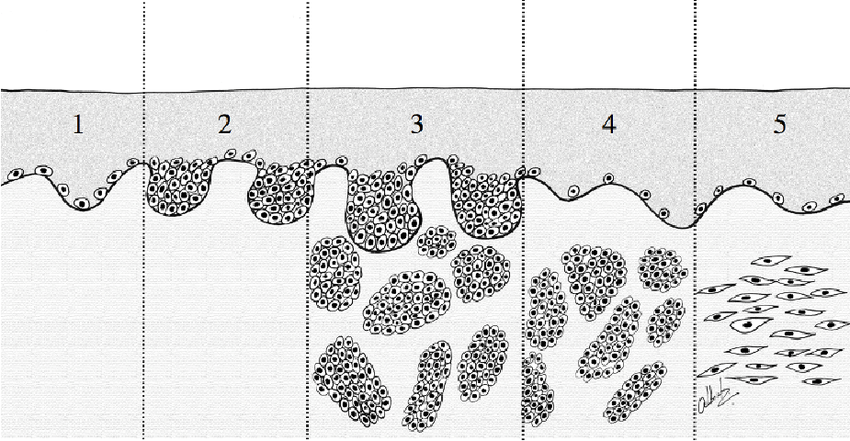
Angeborene melanozytäre Nävi sind selten, sie treten nur bei einem von 100 bis 200 Neugeborenen auf. Der Großteil der Leberflecken – durchschnittlich 30 Stück bei einem deutschen Erwachsenen – entwickelt sich bis zum 20. Lebensjahr [15]. Diese Leberflekcen werden als erworbene melanozytäre Nävi bezeichnet. Dunkelhäutige Menschen haben kaum oder keine melanozytären Nävi.
Entstehung
Weil Leberflecken familiär gehäuft auftreten, könnte die Neigung zur Ausildung von Nävuszellnävi genetisch bedingt sein. Hat ein Elternteil viele Leberflecke, tendieren auch die Kinder dazu, viele Pigmentflecken zu entwickeln. Neben der genetischen Disposition scheinen Sonnenstrahlung, hormonelle Veränderungen, Medikamente und Stress eine wesentliche Rolle zu spielen.
Genetische Ursachen
Das am besten untersuchte Gen im Zusammenhang mit der Entstehung erworbener melanozytärer Nävi ist BRAF. Eine Mutation des BRAF-Gens fördert die Aggregation von Melanozyten zu melanozytären Nävi [16]. Diesselbe Mutation löst auch die Produktion eines Tumorsuppressorproteins namens p15 aus. Dieses verhindert, dass Leberflecken zu groß werden. In seltenen Fällen führen BRAF-Genvarianten zusammen mit der Deletion des CDKN2A-Gens zu einem Mangel an p15, was dazu führt, dass Nävuszellen unkontrolliert wachsen und entarten können [17]. Angeborene melanozytäre Nävi weisen dagegen häufig NRAS-Mutationen und GNAQ-Mutationen auf [16].
Sonnenlicht
Über den Einfluss der Sonne auf die Entstehung von Nävuszellnävi existieren viele Studien. Eine Erkenntnis aus diesen Studien ist, dass Leberflecken bei Kindern und jungen Menschen bevorzugt an Körperstellen entstehen, die der Sonne ausgesetzt sind. Zudem haben Kinder mit häufigen oder schweren Sonnenbränden mehr Leberflecken als Kinder ohne Verbrennungen.
Allerdings bilden sich Leberflecken bei Erwachsenen unter Sonnenexposition auch schneller wieder zurück. In einer schwedischen Studie hatten Probanden, die in Innenräumen arbeiteten, deutlich mehr Leberflecken als Outdoor-Arbeiter.

Ein eindeutiger Zusammenhang zwischen Hauttyp, Haarfarbe und der Anzahl melanozytärer Nävi konnte nicht nachgewiesen werden. Möglicherweise meiden hellhäutige Menschen mit empfindlicher Haut die Sonne eher und entwickeln deshalb weniger Leberflecken als zu erwarten wäre. Insgesamt ist die Studienlage bei Erwachsenen widersprüchlich und mit Unsicherheiten behaftet [18].
Östrogene
In der Pubertät und während Schwangerschaften werden melanozytäre Nävi oft dunkler und vermehren sich. Ursache ist der Anstieg des Sexualhormons Östrogen. Melanozyten verfügen über Östrogen-Rezeptoren, die die Melaninproduktion fördern und melanozytäre Nävi zum Wachstum anregen. Frauen mit vielen Leberflecken leiden gleichzeitig häufiger an hormonabhängigen Krankheiten wie Endometriose, Uterusmyomen und Brusttumoren. Nävuszellnävi können deshalb ein Biomarker für eine hohe Östrogen-Exposition sein [19].
Medikamente
Wenn Hunderte von Leberflecken innerhalb kurzer Zeit entstehen, spricht man von Eruptiven melanozytären Nävi (EMN). Diese können auf allen Hautflächen einschließlich Handflächen und Fußsohlen auftreten. EMN sind ein bekanntes Phänomen bei AIDS, nach blasenbildenden Dermatosen, als Begleiterscheinung immunsuppressiver Therapien und bei Chemotherapien [20,21]. Durch den vermehrten Einsatz von Biologika zur Behandlung von Autoimmunerkrankungen haben EMN in den letzten 15 Jahren signifikant zugenommen [22].
Die genaue Ursache der EMN ist nicht vollends geklärt, lässt sich aber in vielen Fällen auf eine Schwächung des Immunsystems zurückführen. In Studien korrelierte die Vermehrung von Nävi mit der Zunahme Regulatorischer T-Zellen, während Zytotoxische T-Zellen die Proliferation der Melanozyten verhinderten [23]. Teilweise bildeten sich die Leberflecken nach dem Absetzen der immunsuppressiven Therapie zurück [24,25]. Im Fall der blasenbildenden Dermatose wird über den Einfluss von Mastzellen spekuliert, da Entstehung der Nävi in Studien mit höheren Serum-Tryptase-Werten korrelierten [20].
Unklar ist auch, ob sich EMN neu entwickeln oder aus vorhandenen, inaktiven und unsichtbaren Vorläuferzellen hervorgehen. Für die zweite These spricht, dass nur ein Teil der Patienten EMN ausbildet, während andere Betroffene eine großflächige medikamenteninduzierte Hyperpigmentierung entwickeln [26].
Nitrosativer und oxidativer Stress
Die „massive Ausbildung von Nävuszellnävi” kann ein Hinweis auf nitrosativen Stress sein. Ursache ist die Nitrierung von Tyrosin, die nach Antibiotikabehandlungen oder Grippeerkrankungen auftreten kann [11*]. 3-Nitrotyrosin in melaninproduzierenden Zellen ist ein Biomarker für oxidativen und nitrosativen Stress. Die antioxidativen Kapazitäten des Melanins ermöglichen das Überleben der Zelle. Übermäßiger Stress führt zur Apoptose der Melanozyten. Der Zelltod gilt als mögliche Ursache der Weißfleckenkrankheit [27].
Schwarzer Hautkrebs
Beim schwarzen Hautkrebs kommt es zu einer ungebremsten Proliferation von Melanozyten aufgrund von Mutationen oder epigenetischen Veränderungen der Zell-DNA. Das Melanom wächst in die tieferen Hautschichten und kann über die Blut- und Lymphgefäße im subkutanen Gewebe metastasieren (Bild unten).
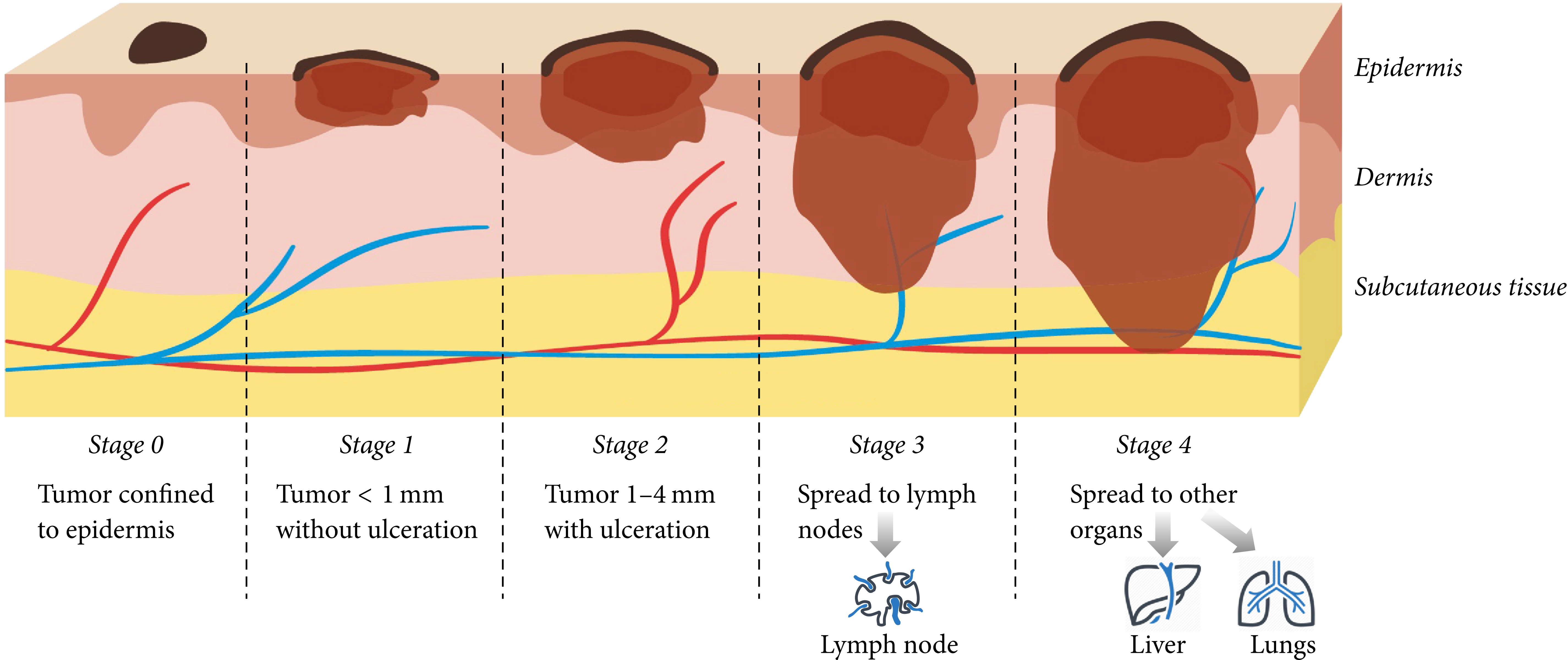
Die Inzidenz des malignen Melanoms ist bei der hellhäutigen Bevölkerung in den USA, Kanada, Australien und Europa in den letzten 50 Jahren kontinuierlich gestiegen [17,28]. Alleine in Deutschland hat sich die Erkrankungsrate zwischen 1980 und 2005 nahezu vervierfacht (Bild unten). Seit 2012 hat sich die Inzidenz auf einem hohen Niveau (∼ 20 je 100.000 Personen) eingependelt [29].
Für die weltweite Zunahme maligner Melanome gibt es zwei Hypothesen: 1. Vermehrte Sonnenexposition und 2. das höhere Alter der Bevölkerung.
Für die erste Hypothese gibt es keine Belege. Im Gegenteil, die meisten Menschen verbringen heute sehr viel weniger Zeit in der Sonne als vor 50 oder 100 Jahren. Beruflich halten sie sich überwiegend in geschlossenen Räumen auf. Nur wenige arbeiten in klassischen Outdoor-Berufen wie der Landwirtschaft [30]. Die zweite Hypothese ist falsch, denn die Lebenserwartung ist über zwei Jahrzehnte ungefähr konstant geblieben. Zudem betrifft der schwarze Hautkrebs viele junge Menschen. In den USA ist das maligne Melanom der am dritthäufigsten diagnostizierte Krebs in der Gruppe der 20- bis 39-Jährigen [31].
Die Sonne – Freund oder Feind?
Das ultraviolette Spektrum der Sonne wird in drei Wellenlängenbereiche eingeteilt:
UV-A-Strahlung (315–400 nm) wird von der DNA nicht absorbiert. UV-A- und sichtbares Licht (400-700 nm) können jedoch Singulett-Sauerstoff erzeugen, der die DNA indirekt über Photosensibilisierungsreaktionen schädigen kann [33].
UV-B-Strahlung (280–315 nm) macht weniger als 1 % der Sonnenenergie aus. Sie greift direkt in die Bindung zwischen den Nukleotiden in der DNA ein. Hierdurch entstehen Pyrimidin-Dimere, die die Molekularstruktur der DNA verändern und zu weiteren Mutationen im Genom führen können [33,34].
UV-C-Strahlung (<280 nm) wird von Sauerstoff und Ozon in der Erdatmosphäre weitgehend absorbiert und hat daher kaum schädliche Auswirkungen [33].
Der Körper kann Schäden im Erbgut der Hautzellen bis zu einem gewissen Maß reparieren oder die Apoptose einleiten [33]. Ist die Haut zu lange oder zu oft ungeschützt der UV-Strahlung ausgesetzt, kann das körpereigene Reparatursystem überlastet sein und beschädigte Zellen bleiben zurück. Das spezifische Muster einer DNA-Mutation wird als Signatur bezeichnet. Über die Signatur lassen sich UV-Schäden von anderen DNA-Mutationen unterscheiden. Die Mehrheit der mit dem malignen Melanom assoziierten Gene enthält UV-Signaturen.
Allerdings enthält die DNA entarteter Melanozyten auch eine Vielzahl nicht UV-bedingter Mutationen [34]. Auch entstehen viele Melanome an Körperstellen, die nicht der Sonne ausgesetzt sind, beispielsweise in der Mundschleimhaut, an den Fußsohlen oder unter den Fingernägeln [35]. Einige Studien stellen die Kausalität von Sonne und schwarzem Hautkrebs generell infrage:
- Beim schwarzen Hautkrebs konnte – anders als beim Plattenepithelkarzinom oder dem Basalzellkarzinom – kein Zusammenhang mit der Sonnenexposition hergestellt werden (“Melanoma is not caused by sunlight”) [36].
- In Europa und den USA hat die Sonnenexposition stark abgenommen, während die Inzidenz des Melanoms dramatisch zugenommen hat (“Exponentially increasing incidences of cutaneous malignant melanoma in Europe correlate with low personal annual UV doses […]”) [37].
- Menschen, die im Freien arbeiten, haben trotz Sonnenbränden ein deutlich geringeres Risiko, am Melanom zu erkranken. Dagegen ist die Inzidenz bei Arbeitern in geschlossenen Räumen exponentiell gestiegen [37].
- Die Verwendung von Sonnenschutzmitteln hat das Melanom-Risiko nicht verringert. Vielmehr hat die Krankheit in dem Maße zugenommen, wie die Verwendung von Sonnenschutzmitteln gestiegen ist (“Rising trends in melanoma. An hypothesis concerning sunscreen effectiveness”) [37,38].
Dass sonnenexponierte Probanden seltener Melanome bekommen, lässt sich auf ihren höheren Vitamin-D-Spiegel zurückführen. Vitamin D3 wird bei UV-B-Exposition in der menschlichen Haut gebildet (Bild unten).
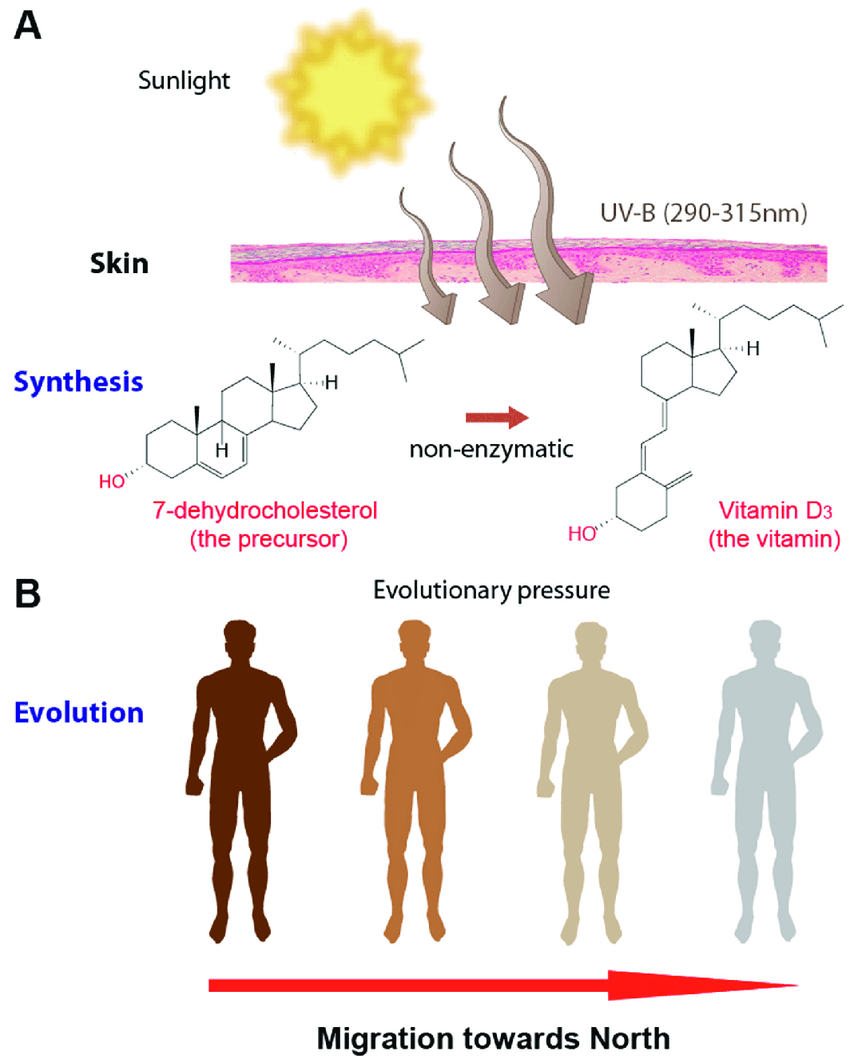
Die Anti-Krebs-Wirkung des “Sonnenvitamins” ist vielfach belegt [39,40]. Auch andere gesundheitsfördernde Effekte des Sonnenlichts werden diskutiert, etwa die Freisetzung von Stickstoffmonoxid auf der Haut oder der Einfluss von UV-Licht auf periphere Blutzellen [41].
Dagegen ist ein Mangel an natürlichem Sonnenlicht mit Krankheiten wie Brustkrebs, Darmkrebs, Bluthochdruck, Multiple Sklerose, Alzheimer, Asthma und Typ-1-Diabetes assoziiert. Dunkelhäutige Menschen haben ein höheres Risiko, weil das Melanin in ihrer Haut einen Großteil der UV-Strahlung absorbiert. Schätzungen zufolge sterben jedes Jahr 340.000 Menschen in den USA und 480.000 in Europa an den Folgen von zu wenig Sonnenlicht [40,41].
Diese Zahlen sind ein starkes Indiz, dass die positiven Wirkungen des Sonnenlichts die potentiellen Schäden durch Sonnenbrände und DNA-Mutationen überwiegen. Ein Zusammenhang zwischen Sonnenexposition und Melanomen besteht nicht. Nachgewiesen ist allerdings, dass häufige Sonnenbrände generell das Risiko für alle Arten von Hautkrebs erhöhen [41].
Achtung Sonnencreme!
Zur Prävention von Sonnenbrand existiert eine reichhaltige Auswahl an Cremes und Kosmetika mit UV-Schutz. Die in ihnen enthaltenen chemischen UV-Filter dringen in die Haut ein und bilden einen Schutzfilm, der die UV-Strahlung der Sonne in Wärme umwandelt. Allerdings warnt die Arbeitsgemeinschaft der Dermatologischen Prävention e.V. auf ihrer Webseite: “Es ist noch nicht ausreichend bewiesen, dass Sonnenschutzmittel vor dem Schwarzen Hautkrebs (Malignes Melanom) oder dem Basalzellkrebs schützen. Für den Stachelzellkrebs lassen die Daten nur die Aussage eines “wahrscheinlichen” Schutzes zu.” [42]
Was die ADP nicht erwähnt, ist, dass die Inzidenz des malignen Melanoms mit der Nutzung von Sonnenschutzmitteln gestiegen ist [37,38]. Dass Sonnencremes unserer Gesundheit mehr schaden als nutzen, hat mehrere Gründe:
-
Die UV-Filter beeinträchtigen die Vitamin-D-Produktion in der Haut [40]. Wer sich an die von der Weltgesundheitsorganisation empfohlene Menge an Sonnenschutzmittel und Lichtschutzfaktor (SPF 15+) hält, bildet gar kein Vitamin D in der Haut. Allerdings steigt die Vitamin-D-Produktion exponentiell, je dünner das Sonnenschutzmittel aufgetragen wird [43]. Bei Melanom-Patienten korrelieren niedrige Vitamin-D3-Spiegel mit einer größeren Tumordicke und einem fortgeschrittenen Tumorstadium [34].
-
Manche Sonnencremes blockieren zwar UV-B-Strahlung aber kein UV-A. Die DNA-schädigende Wirkung eines UV-A-Photos ist circa 1.000 Mal schwächer als die eines UV-B-Photons. Allerdings kann das UV-A-Licht der Sonne abhängig von Tageszeit, Jahreszeit, Breitengrad und Höhe 20-40 Mal intensiver sein. Noch intensiver ist die UVA-Strahlung durch Fensterglas und auf Sonnenbänken. Menschen in allen Altersgruppen erkranken signifikant häufiger an schwarzem Hautkrebs, wenn das Verhältnis von UV-A zu UV-B der Lichtexposition groß ist [34,38].
-
Sonnencremes enthalten endokrine Disruptoren (Tabelle unten). Dazu gehören chemische UV-Filter wie Oxybenzon, Titandioxid, Paraaminobenzoesäure, Octinoxat, Enzacamen, Homosalat und andere [44]. Diese binden an Östrogen-Rezeptoren in den Zellen, wo sie den Hormonhaushalt stören und die Genexpression verändern (siehe auch Die Endokrine Evolution).
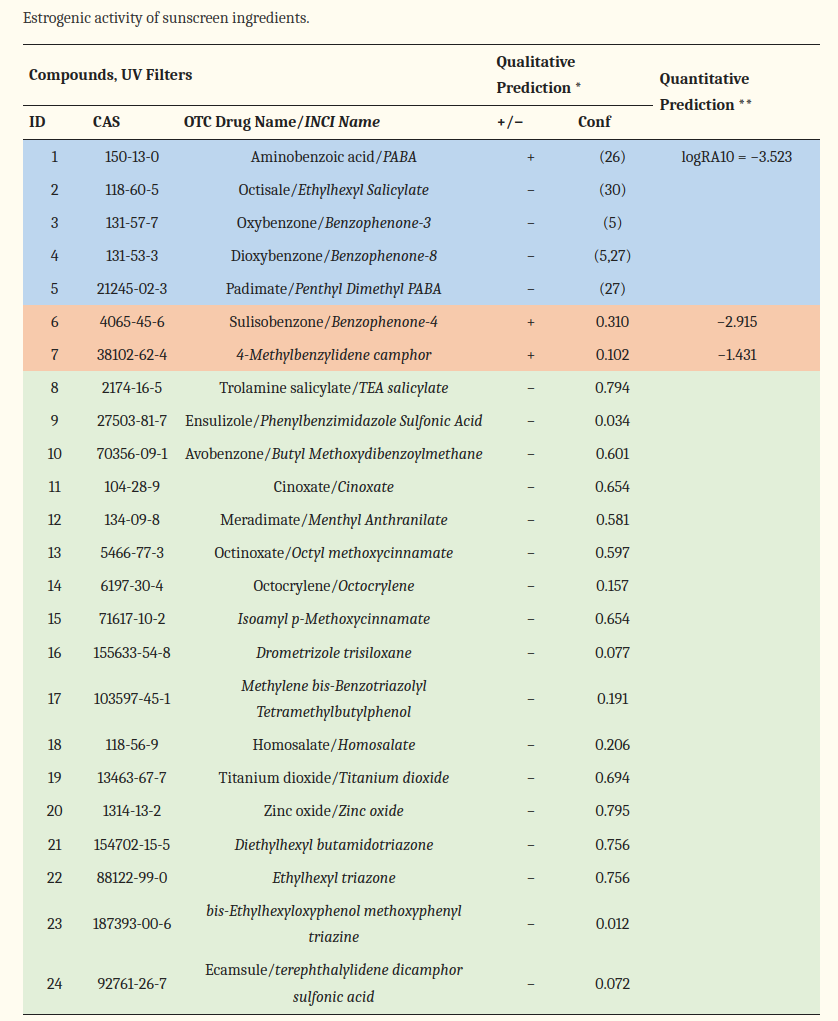
Östrogene werden mit einer Reihe von Krebsarten in Verbindung gebracht, darunter Brust-, Eierstock- und Gebärmutterschleimhautkrebs. Ebenso stehen Östrogene im Verdacht, das Wachstum und die Metastasierung maligner Melanome zu fördern [45,46]. Die Bindung an den ER-Rezeptor könnte erklären, warum die Inzidenz mit der Benutzung von Sonnencreme gestiegen ist.
Wie stark Mensch und Natur mit Chemikalien aus Sonnencremes belastet sind, zeigen Studien aus den USA und der Schweiz: 96 % der untersuchten Urinproben und 85 % der Muttermilch-Proben enthielten Oxybenzon und andere UV-Filter [47]. Die Chemikalien reichern sich im Trinkwasser und in den Meeren an, wo sie Menschen und Tiere vergiften und Korallen zerstören [48].
Umweltgifte: The Ugly
Weil Melanin Giftstoffe bindet, sind Melanozyten extrem anfällig für endokrine Disruptoren und chemische Kanzerogene. Tierversuche zeigen, dass Aflatoxin, N-Nitrosamine, Benzidin, PAK und andere Chemikalien in melaninhaltigen Zellen akkumulieren. Die Ergebnisse der Tierstudien decken sich mit dem gehäuften Auftreten von Melanomen bei Arbeitern in der chemischen Industrie – insbesondere in Hautbereichen, die nie dem Sonnenlicht ausgesetzt waren. [10,49].
Bisphenole, die als Weichmacher zu den weltweit am meisten verbreiteten Industriechemikalien gehören, binden an Östrogen-Rezeptoren und fördern die Zellproliferation. Weil Bisphenole die Enzyme der Melanin-Synthese blockieren, ist die Haut gleichzeitig schlechter vor UV-Strahlung geschützt [4]. In Europa, Nordamerika und China wurde ein signifikanter Zusammenhang zwischen der Belastung mit polychlorierten Biphenylen (PCB) und dem Auftreten von malignen Melanomen nachgewiesen [50]. Zwar wurden PCB in den 1980er Jahren verboten, sie zirkulieren aber bis heute in Luft, Böden und Gewässern.
Auch Alkohol und Medikamente sind Risikofaktoren: Personen, die mehr als ein alkoholisches Getränk pro Woche trinken, erkranken häufiger am schwarzen Hautkrebs als Nicht-Trinker. Das Risiko steigt mit zunehmendem Alkoholkonsum [51]. Männer, die Viagra nehmen, haben ein höheres Risiko für Melanome – nicht jedoch für Plattenepithelkarzinome oder Basalzellkarzinome. Der als Wirkstoff eingesetzte PDE-5-Hemmer hat eine kanzerogene Wirkung auf Melanozyten, die im Detail noch nicht verstanden ist [52].
In der wissenschaftlichen Literatur finden sich viele signifikante Zusammenhänge zwischen Schadstoff-Exposition und dem Auftreten maligner Melanome [49]. Manche Chemikalien werden durch die UV-Strahlung der Sonne aktiviert oder in ihrer Wirkung beschleunigt. Hieraus resultiert eine Scheinkausalität zwischen Sonnenexposition und schwarzem Hautkrebs.
Beispielsweise entfaltet der UV-Filter Benzophenon erst in der Sonne seine ganze toxische Wirkung [53]. Man könnte lachen, wenn es nicht so traurig wäre.
Mein Umgang mit der Sonne
Im Frühjahr gewöhne ich meine Haut langsam an die Sonne, bevor ich im Sommer an den See oder Strand gehe. Ich bevorzuge die Mittagssonne, weil der relative UV-B-Anteil dann am größten ist. So bringe ich auch meinen Vitamin-D-Spiegel auf ein optimales Niveau (30 – 160 ng/ml bzw. 75 – 400 nmol/l). Wenn meine Haut zu heiß wird, gehe ich in den Schatten oder ziehe etwas an.
Obwohl ich helle Haare habe, werde ich braun. Sonnencreme benutze ich nur, wenn ich lange Zeit im Freien bin und dabei nicht in den Schatten gehen kann. Falls ich einmal zu viel Sonne abbekommen habe, benutze ich Aloe-Vera-Gel. Ich bewahre es im Kühlschrank auf und gebe es nach dem Duschen auf die Haut.
No Sunglasses
UV-B-Strahlung stimuliert die Ausschüttung des Hormons MSH (Melanozyten-stimulierendes Hormon) in der Hirnanhangdrüse. Das Hormon sorgt dafür, dass die Melanozyten das Pigment Melanin produzieren und die Haut bräunt. Dabei führt die UV-B-Bestrahlung der Augen zu einem signifikanten Anstieg der MSH-Konzentration im Plasma. Mit anderen Worten: Ohne Sonnenbrille wird man schneller braun und ist besser vor Sonnenbrand geschützt [55,56]. Deshalb trage ich Sonnenbrillen nur in den Bergen, bei Fahrtwind auf dem Fahrrad oder wenn mich die Sonne beim Autofahren blendet.
Schutz vor oxidativem Stress
Wenn die Zellen mehr Radikale produzieren als sie über Antioxidantien neutralisieren können, entsteht oxidativer Stress (Bild unten).
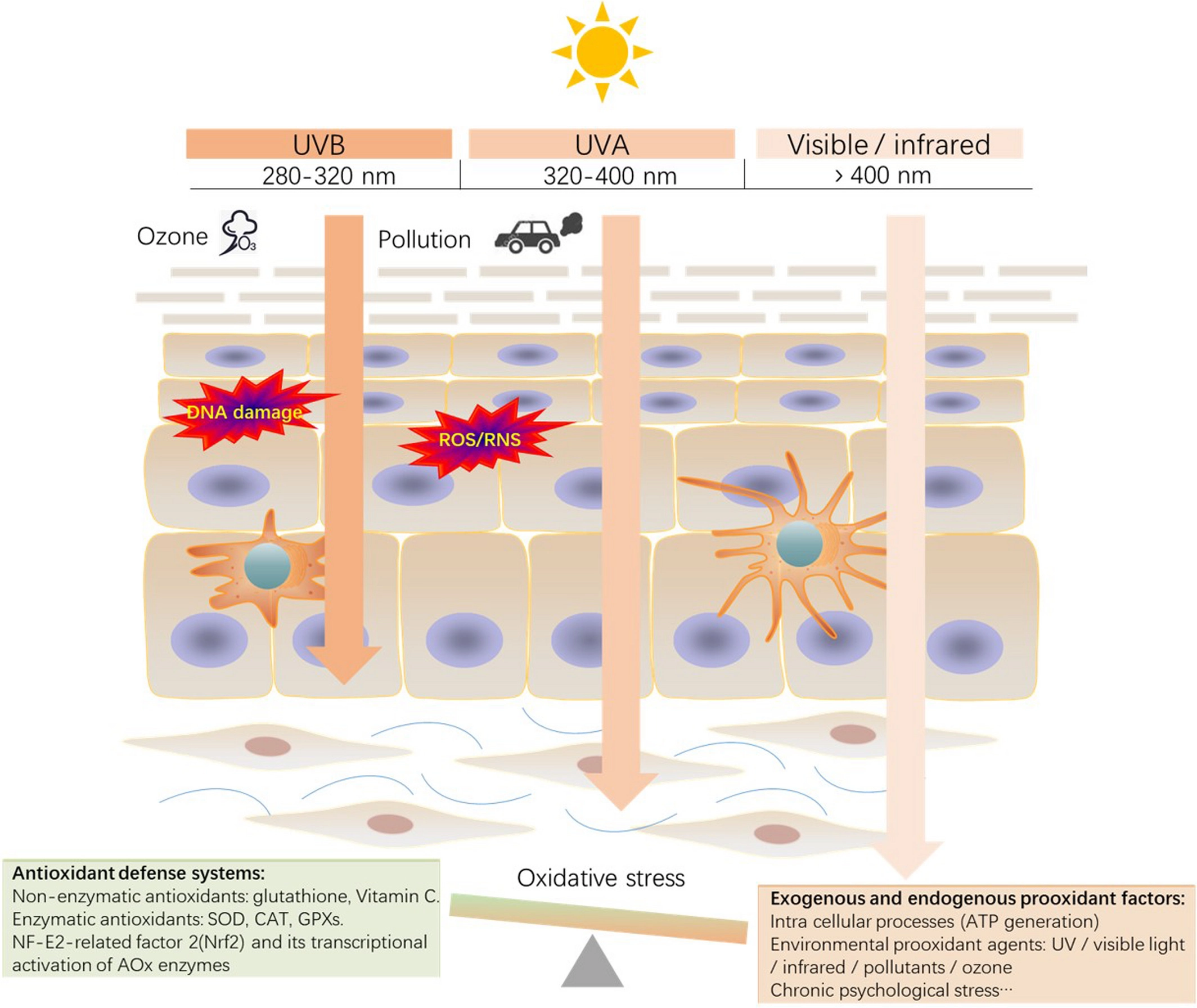
Oxidativer Stress beschädigt die DNA, beschleunigt die Hautalterung und fördert die Entstehung von Altersflecken. Vitamine und Antioxidantien schützen die Haut [51,54]. In der Tabelle unten findest Du eine Auswahl an natürlichen Lebensmitteln mit einem hohen Gehalt an Antioxidantien.
| Antioxidantien | Vorkommen |
|---|---|
| Vitamin E | Ölsaaten, Walnüsse, Paranüsse, Lebertran, Olivenöl, Schwarzwurzeln |
| Vitamin C | Obst (z. B. Acerola, Kiwi), Zitrusfrüchte, Gemüse (z.B. Paprika, Grünkohl), Kräuter (z. B. Petersilie) |
| Polyphenole (Resveratrol, Flavonoide) |
Kakao, Traubenkernextrakt, rote und blaue Beeren, Rotwein, Kaffee, Grüntee |
| Coenzym Q10 | Öliger Fisch, Fleisch, Eier, Nüsse |
| Selen | Innereien, (Stein-)Pilze, Nüsse, Muscheln, Fisch, Eier, Knoblauch, Zwiebeln |
| Zink | Muscheln (Austern), Ölsaaten, Innereien, Eigelb, Paranüsse, Cashewkerne |
Bei Nahrungsmittelunverträglichkeiten oder hohem Nährstoffbedarf können Nahrungsergänzungsmittel sinnvoll sein. Ich nehme zum Beispiel Zink, Selen und Vitamin C, im Strandurlaub außerdem täglich Vitamin E*. Für mehr Tipps zur Ernährung empfehle ich Dir meinen Artikel über Altersflecken. Sehr umfangreiche Informationen zu oxidativem Stress findest Du auch in meinen Artikeln über Sauerstoffradikale und Stickstoffradikale.
Leberflecken als Gesundheitsrisiko?
Die Mehrzahl der malignen Melanome entsteht de novo (70-80 %). Die meisten Melanom-Patienten haben weder klinisch auffällige Nävi noch eine erhöhte Anzahl von Leberflecken. Nur ein kleiner Teil aller Melanome bildet sich auf dem Boden von Nävuszellen. Das Lebenszeitrisiko, dass sich ein einzelner Nävus in ein Melanom verwandelt, wird auf weniger als eins zu 1000 geschätzt [57].
Nichtsdestotrotz sollte man seine Leberflecken im Auge behalten und etwaige Veränderungen beim Dermatologen abklären lassen. Ein sehr hilfreiches Schema für die Beurteilung von Leberflecken ist die ABCDE-Regel. Falls Du immunsupprimierende Medikamente nimmst, solltest Du mit Deinem Arzt über mögliche Risiken der UV-Exposition sprechen. Falls Du in kurzer Zeit viele neue Leberflecken bekommst, könnte nitrosativer Stress ein Grund sein [11*].
Der Wirkstoff N-Acetylcystein* (NAC) kann Nävuszellen vor oxidativem Stress schützen. NAC ist ein zelldurchlässiges Antioxidans, das im Körper zu L-Cystein und dann zu Glutathion umgewandelt wird. Als Hautkrebs-Prophylaxe sollte NAC kurz vor einer akuten UV-Exposition eingenommen werden [58,59].
* Als Amazon-Partner verdiene ich an qualifizierten Verkäufen
Quellen
- Zentrum für Krebsregisterdaten: Krebsarten
- https://www.unserehaut.de/de/sonne/UV-Strahlung.php
- Aranow C. Vitamin D and the immune system. J Investig Med. 2011 Aug;59(6):881-6
- Venkatesan H, Soundhararajan R, Srinivasan H. Interaction of various types of bisphenols with enzymes involved in melanin synthesis. Toxicol. Environ. Health Sci. 2022;14(1):19–24
- LaBerge GS, Duvall E, Grasmick Z, Haedicke K, Galan A, Leverett J, Baswan S, Yim S, Pawelek J. Recent Advances in Studies of Skin Color and Skin Cancer. Yale J Biol Med. 2020 Mar 27;93(1):69-80
- Madkhali, N., Alqahtani, H., Al-Terary, S. et al. Control of optical absorption and fluorescence spectroscopies of natural melanin at different solution concentrations. Opt Quant Electron 51, 227 (2019)
- Sarna, T. and H. A. Swartz (1998) The physical properties of melanin. In The Pigment System: Physiology and Pathophysiology (Edited by J. J. Nordland, R. E. Boissy, V. J. Hearing, R. A. King and J.-P. Ortonne) pp. 333– 358. Oxford University Press, Oxford
- Hu DN, Simon JD, Sarna T. Role of ocular melanin in ophthalmic physiology and pathology. Photochem Photobiol. 2008 May-Jun;84(3):639-44
- Ings, R. M. J. (1984). The Melanin Binding of Drugs and Its Implications. Drug Metabolism Reviews, 15(5-6), 1183–1212
- Larsson BS. Interaction between chemicals and melanin. Pigment Cell Res. 1993 Jun;6(3):127-33
- Dr. sc. med. Kuklinski J. Mitochondrien: Symptome, Diagnose und Therapie, Herausgeber: Aurum in Kamphausen Media GmbH. Auflage: 3 (2018) Buch*
- Karlsson O, Lindquist NG. Melanin and neuromelanin binding of drugs and chemicals: toxicological implications. Arch Toxicol. 2016 Aug;90(8):1883-91
- https://de.wikipedia.org/wiki/Pigmentnävus
- Cardoso LB, Consalaro A, da Silva Santos PS, da Silva Sampieri MB, Tinoco-Araújo JE. Oral compound nevus. Dermatol Online J. 2014 Feb 18;20(2)
- SpringerMedizin. Melanozytäre Nävi und Melanom. Verfasst von: C. Garbe, H. Kerl und L. Cerroni. Publiziert am: 05.08.2015
- Roh MR, Eliades P, Gupta S, Tsao H. Genetics of melanocytic nevi. Pigment Cell Melanoma Res. 2015 Nov;28(6):661-72
- Taylor LA, O’Day C, Dentchev T, Hood K, Chu EY, Ridky TW, Seykora JT. p15 Expression Differentiates Nevus from Melanoma. Am J Pathol. 2016 Dec;186(12):3094-3099
- Gallagher RP, McLean DI. The epidemiology of acquired melanocytic nevi. A brief review. Dermatol Clin. 1995 Jul;13(3):595-603
- Fuhrman B, Cardenas V. Melanocytic nevi as biomarkers of breast cancer risk. PLoS Med. 2014 Jun 10;11(6):e1001661
- Burian EA, Jemec GBE. Eruptive Melanocytic Nevi: A Review. Am J Clin Dermatol. 2019 Oct;20(5):669-682
- Meneguzzo A, Lazzarotto A, Alaibac M. Eruptive Melanocytic Nevi Secondary to Encorafenib for BRAF Mutant Metastatic Colorectal Cancer. In Vivo. 2020 Jan-Feb;34(1):441-445
- Cãlugãreanu, Andreea & Bloju, Mihaela & Mihai, Mara Madalina & Catanã, Remulus & Giurcãneanu, Cãlin & Orzan, Olguta. (2018). ERUPTIVE MELANOCYTIC NEVI. Dermatovenerologia. 63
- Nasti TH, Yusuf N, Sherwani MA, Athar M, Timares L, Elmets CA. Regulatory T Cells Play an Important Role in the Prevention of Murine Melanocytic Nevi and Melanomas. Cancer Prev Res (Phila). 2021 Feb;14(2):165-174
- Piaserico S, Alaibac M, Fortina AB, Peserico A. Clinical and dermatoscopic fading of post-transplant eruptive melanocytic nevi after suspension of immunosuppressive therapy. J Am Acad Dermatol. 2006 Feb;54(2):338-40
- Zattra E, Fortina AB, Bordignon M, Piaserico S, Alaibac M. Immunosuppression and melanocyte proliferation. Melanoma Res. 2009 Apr;19(2):63-8
- Ross AL, Sanchez MI, Grichnik JM. Nevogenesis: a benign metastatic process? ISRN Dermatol. 2011;2011:813513
- Slominski A, Zmijewski MA, Pawelek J. L-tyrosine and L-dihydroxyphenylalanine as hormone-like regulators of melanocyte functions. Pigment Cell Melanoma Res. 2012 Jan;25(1):14-27
- https://de.wikipedia.org/wiki/Malignes_Melanom
- Zentrum für Krebsregisterdaten: Malignes Melanom
- Ian D. Wyatt and Daniel E. Hecker. Occupational changes in the 20th century. Monthly Labor Review, 2006 pp 35-57: Office of Occupational Statistics and Employment Projections, Bureau of Labor Statistics
- Miller KD, Fidler-Benaoudia M, Keegan TH, Hipp HS, Jemal A, Siegel RL. Cancer Statistics for Adolescents and Young Adults, 2020. CA Cancer J Clin (2020) 70(6):443–59
- Jaworek-Korjakowska, J., & Kleczek, P. (2018). eSkin: Study on the Smartphone Application for Early Detection of Malignant Melanoma. Wirel. Commun. Mob. Comput., 2018
- Rastogi RP, Richa, Kumar A, Tyagi MB, Sinha RP. Molecular mechanisms of ultraviolet radiation-induced DNA damage and repair. J Nucleic Acids. 2010 Dec 16;2010:592980
- Arisi M, Zane C, Caravello S, Rovati C, Zanca A, Venturini M, Calzavara-Pinton P. Sun Exposure and Melanoma, Certainties and Weaknesses of the Present Knowledge. Front Med (Lausanne). 2018 Aug 30;5:235
- Rawson RV, Johansson PA, Hayward NK, Waddell N, Patch AM, Lo S, Pearson JV, Thompson JF, Mann GJ, Scolyer RA, Wilmott JS. Unexpected UVR and non-UVR mutation burden in some acral and cutaneous melanomas. Lab Invest. 2017 Feb;97(2):130-145
- Christophers AJ. Melanoma is not caused by sunlight. Mutat Res. 1998 Nov 9;422(1):113-7
- Merrill SJ, Ashrafi S, Subramanian M, Godar DE. Exponentially increasing incidences of cutaneous malignant melanoma in Europe correlate with low personal annual UV doses and suggests 2 major risk factors. Dermatoendocrinol. 2015 Feb 27;7(1):e1004018
- Garland CF, Garland FC, Gorham ED. Rising trends in melanoma. An hypothesis concerning sunscreen effectiveness. Ann Epidemiol. 1993 Jan;3(1):103-10
- Carlberg C. Nutrigenomics of Vitamin D. Nutrients. 2019 Mar 21;11(3):676
- Garland CF, Garland FC, Gorham ED, Lipkin M, Newmark H, Mohr SB, Holick MF. The role of vitamin D in cancer prevention. Am J Public Health. 2006 Feb;96(2):252-61
- Alfredsson L, Armstrong BK, Butterfield DA, Chowdhury R, de Gruijl FR, Feelisch M, Garland CF, Hart PH, Hoel DG, Jacobsen R, Lindqvist PG, Llewellyn DJ, Tiemeier H, Weller RB, Young AR. Insufficient Sun Exposure Has Become a Real Public Health Problem. Int J Environ Res Public Health. 2020 Jul 13;17(14):5014
- https://www.unserehaut.de/de/sonne/sonnenschutz/
- Faurschou A, Beyer DM, Schmedes A, Bogh MK, Philipsen PA, Wulf HC. The relation between sunscreen layer thickness and vitamin D production after ultraviolet B exposure: a randomized clinical trial. Br J Dermatol. 2012 Aug;167(2):391-5
- Hong H, Rua D, Sakkiah S, Selvaraj C, Ge W, Tong W. Consensus Modeling for Prediction of Estrogenic Activity of Ingredients Commonly Used in Sunscreen Products. Int J Environ Res Public Health. 2016 Sep 29;13(10):958
- Janik ME, Bełkot K, Przybyło M. Is oestrogen an important player in melanoma progression? Contemp Oncol (Pozn). 2014;18(5):302-6.
- Bhari N, Schwaertz RA, Apalla Z, Salerni G, Akay BN, Patil A, Grabbe S, Goldust M. Effect of estrogen in malignant melanoma. J Cosmet Dermatol. 2022 May;21(5):1905-1912
- Krause M, Klit A, Blomberg Jensen M, Søeborg T, Frederiksen H, Schlumpf M, Lichtensteiger W, Skakkebaek NE, Drzewiecki KT. Sunscreens: are they beneficial for health? An overview of endocrine disrupting properties of UV-filters. Int J Androl. 2012 Jun;35(3):424-36
- DiNardo JC, Downs CA. Dermatological and environmental toxicological impact of the sunscreen ingredient oxybenzone/benzophenone-3. J Cosmet Dermatol. 2018 Feb;17(1):15-19
- Dika E, Fanti PA, Vaccari S, Patrizi A, Maibach HI. Causal relationship between exposure to chemicals and malignant melanoma? A review and study proposal. Rev Environ Health. 2010 Jul-Sep;25(3):255-9
- Cao J, Fan T, Li W, Xiao S. Association study between plasma levels of polychlorinated biphenyls and risk of cutaneous malignant melanoma. Environ Int. 2019 May;126:298-301
- Millen AE, Tucker MA, Hartge P, Halpern A, Elder DE, Guerry D 4th, Holly EA, Sagebiel RW, Potischman N. Diet and melanoma in a case-control study. Cancer Epidemiol Biomarkers Prev. 2004 Jun;13(6):1042-51
- Li WQ, Qureshi AA, Robinson KC, Han J. Sildenafil use and increased risk of incident melanoma in US men: a prospective cohort study. JAMA Intern Med. 2014 Jun;174(6):964-70
- Hayashi T, Okamoto Y, Ueda K, Kojima N. Formation of estrogenic products from benzophenone after exposure to sunlight. Toxicol Lett. 2006 Nov 1;167(1):1-7
- Chen J, Liu Y, Zhao Z, Qiu J. Oxidative stress in the skin: Impact and related protection. Int J Cosmet Sci. 2021 Oct;43(5):495-509
- Hiramoto K, Yanagihara N, Sato EF, Inoue M. Ultraviolet B irradiation of the eye activates a nitric oxide-dependent hypothalamopituitary proopiomelanocortin pathway and modulates functions of alpha-melanocyte-stimulating hormone-responsive cells. J Invest Dermatol. 2003 Jan;120(1):123-7
- Hiramoto K, Yamate Y, Kobayashi H, Ishii M, Sato EF, Inoue M. Ultraviolet B irradiation of the mouse eye induces pigmentation of the skin more strongly than does stress loading, by increasing the levels of prohormone convertase 2 and α-melanocyte-stimulating hormone. Clin Exp Dermatol. 2013 Jan;38(1):71-6
- Cymerman RM, Shao Y, Wang K, Zhang Y, Murzaku EC, Penn LA, Osman I, Polsky D. De Novo vs Nevus-Associated Melanomas: Differences in Associations With Prognostic Indicators and Survival. J Natl Cancer Inst. 2016 May 27;108(10):djw121
- Goodson AG, Cotter MA, Cassidy P, Wade M, Florell SR, Liu T, Boucher KM, Grossman D. Use of oral N-acetylcysteine for protection of melanocytic nevi against UV-induced oxidative stress: towards a novel paradigm for melanoma chemoprevention. Clin Cancer Res. 2009 Dec 1;15(23):7434-40
- Janeczek M, Moy L, Riopelle A, Vetter O, Reserva J, Tung R, Swan J. The Potential Uses of N-acetylcysteine in Dermatology: A Review. J Clin Aesthet Dermatol. 2019 May;12(5):20-26






Comments powered by Talkyard.