Teilen auf
Twitter Facebook LinkedIn WhatsAppSie bilden sich bei einigen Menschen bereits um das 40. Lebensjahr herum – bräunliche Verfärbungen im Gesicht, auf dem Handrücken oder dem Dekolleté, die mit zunehmendem Alter mehr werden und bis zu einigen Zentimetern groß werden können. Die Rede ist von Altersflecken.
Für ihr Entstehen werden die UV-Strahlung der Sonne und der natürliche Alterungsprozess verantwortlich gemacht. Doch das ist nur ein Teil der Wahrheit. Der andere Teil ist, dass sich in den Hautzellen Schadstoffe ansammeln, die von der Zelle nicht mehr entsorgt werden können. Doch warum „vermüllen” die Zellen?
Exozytose
Um Stoffe mit Ihrer Umwelt austauschen zu können, haben Zellen einen eigenen Transportmechanismus, den sogenannten Bläschentransport. Nimmt die Zelle Stoffe auf, werden diese als membranumhülltes Bläschen in das Zellplasma eingeschleust. Dieser Vorgang heißt Endozytose. Ein Beispiel für Endozytose ist die Phagozytose, bei der Fresszellen (Makrophagen) des Immunsystems fremde Viren und Bakterien aufnehmen und zerstören. Der umgekehrte Prozess, bei dem Stoffe aus dem Zellinneren ausgetoßen werden, heißt Exozytose. Dabei fusioniert das Bläschen mit der Zellmembran und gibt so die in seinem Inneren gespeicherten Stoffe frei.
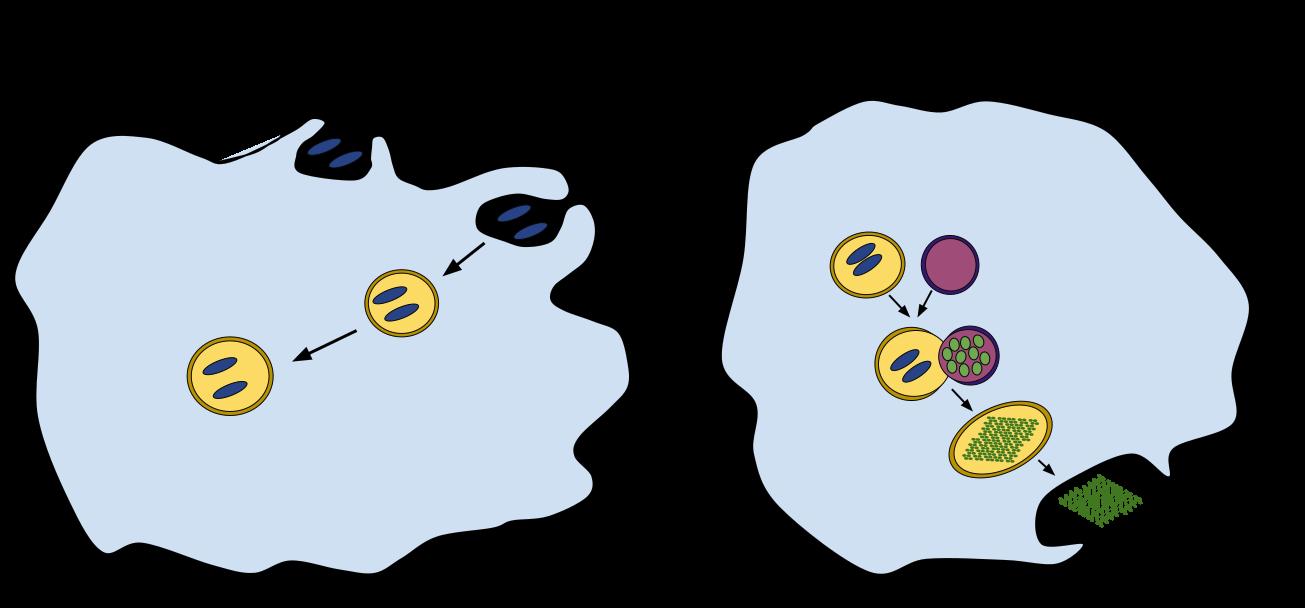
Die Exozytose erfüllt zwei Funktionen:
Sie dient einerseits der Freisetzung von Botenstoffen aus der Zelle in das Blut oder in das sie umgebende Gewebe. Beispiele sind die Ausschüttung von Neurotransmittern in den synaptischen Spalt zwischen den Nervenzellen, die Insulinabgabe ins Blut oder die Freisetzung von Histamin aus den Mastzellen.
Die zweite Funktion der Exozytose ist die Entfernung von Schadstoffen aus der Zelle. Sie erfüllt damit die Funktion der zellulären Müllabfuhr (Abbildung oben rechts). Für die Zersetzung und den Abtransport des Mülls besitzt die Zelle eine Struktur (Zellorganell), die als Lysosom bezeichnet wird. Das Lysosom enthält Verdauungsenzyme, mit denen es Fremdstoffe oder körpereigene Stoffe (in letzterem Fall spricht man von Autophagozytose) abbaut. Lysosomen werden deshalb auch als das Verdauungssystem der Zelle bezeichnet.
Wenn sich der Zellabfall schneller anreichert als er mittels Exozytose entsorgt werden kann, sammelt sich unverdautes Material in den Lysosomen an. Durch die Verschmelzung oxidierter Proteine und Fettsäuren mit anderen Stoffen können Makromoleküle entstehen, die von den Verdauungsenzymen nicht mehr zersetzt werden können. Einer dieser unverdaubaren Reststoffe ist Lipofuszin.
Lipofuszin
Lipofuszin ensteht, wenn entartete ungesättigte Fettsäuren mit anderen oxidativ beschädigten Makromolekülen eine unlösliche Verbindung (cross linking) eingehen [1]. Neben oxidierten Lipiden (20–50%) und Proteinen (30–70%) enthält Lipofuszin zu einem geringen Prozentsatz auch Kohlenhydrate und Metalle wie Eisen, Kupfer, Aluminium, Quecksilber und Zink [2].
Die Oxidation ist eine chemische Reaktion mit einem sogenannten Radikal. Radikale sind besonders reaktionsfreudige Atome oder Moleküle mit mindestens einem ungepaarten Elektron, die anderen Molekülen Elektronen “entreißen”. Zurück bleibt ein denaturiertes Molekül, dass seine ursprünglichen Funktionen nicht mehr erfüllen kann. Bei der Proteinoxidation werden Aminosäuren und die aus ihnen aufgebauten Peptide in ihrer Struktur zerstört [3]. Die Lipidperoxidation führt zu einer Kettenreaktion, bei der sich Fettsäureradikale immer weiter fortplanzen und so Zellmembranen und andere Gewebe zerstören [4].
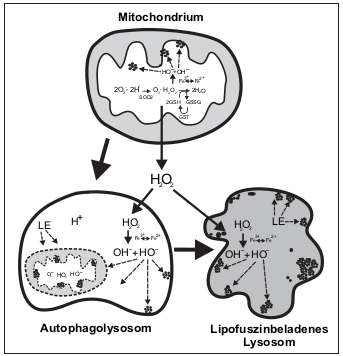
Als Hauptmechanismus der Lipofuszinbildung gilt die Fenton-Reaktion, bei der organische Moleküle mit Wasserstoffperoxid (H2O2) in einem saurem Medium oxidieren. Die Ionen der Eisensalze (Fe2+) dienen dabei als Katalysator. Als Reaktionsprodukte enstehen unter anderem Hydroxyl-Radikale (OH).
Wasserstoffperoxid ensteht bei der zellulären Energieproduktion in den Mitochondrien, von wo aus es ungehindert durch die Zelle und in die Lysosomen diffundiert. Wegen des dort herrschenden sauren Milieus (pH-Wert < 5) läuft die Fenton-Reaktion sehr effizient ab. Die produzierten Radikale oxidieren die in den Lysosomen gespeicherten Proteine und Lipide, welche schließlich zum nicht mehr weiter abbaubaren Lipofuszin fusionieren (siehe Abbildung unten).
Unter dem Lichtmikroskop zeigt sich Lipofuszin als unspezifisch in der Zelle verteilte, gelb-braune Tröpfchen. Wenn sich das Pigment in den Hautzellen mit zunehmendem Alter verdichtet, verfärbt die Haut bräunlich – Ein Altersfleck wird sichtbar. Lipofuszin entsteht allerdings nicht nur in Hautzellen, sondern auch in Muskelzellen, im Herzmuskel, in der Netzhaut der Augen („Gelber Fleck”) und in den Nervenzellen des Gehirns.
Die Trigger der Lipofuszinbildung
Während die angebliche Gefahr durch die Sonnenstrahlung in den Mainstream-Medien in geradezu absurder Weise gehypt wird, werden die wahren Auslöser der Lipofuszin-Bildung verschwiegen. Denn diese machen das (in einem vernünftigen Maß genossene) Sonnenlicht überhaupt erst gefährlich.
Oxidativer Stress
Die Mitochondrien sind die wichtigsten Energieerzeuger der Zellen. Sie haben eine runde bis längliche Form und befinden sich meist in der Nähe besonders stoffwechselaktiver Zellbereiche. Hauptprozess der mitochondrialen Energieerzeugung ist der Abbau von Glukose über den Citronensäurezyklus und die Atmungskette zu Kohlendioxid (CO2) und Wasser (H2O) und die anschließende oxidative Phospholierung, bei der das energiereiche Molekül Adenosintriphosphat (ATP) erzeugt wird. Je nach Energieverbrauch kann eine Zelle bis zu mehrere Tausend Mitochondrien enthalten [6].
Unter physiologischen Bedingungen werden etwa 98 Prozent des bei der Zellatmung verbrauchten Sauerstoffs zu Wasser reduziert. Aus den verbleibenden etwa zwei Prozent entsteht Superoxid (O2–), welches anschließend in Wasserstoffperoxid (2 O2– + 2 H+ ⟶ H2O2 + O2) umgewandelt wird. Produzieren die Mitochondrien dauerhaft eine das physiologische Ausmaß überschreitende Menge an Sauerstoffradikalen und/oder stehen der Zelle nicht ausreichend Stoffe zu deren Neutralisation (Antioxidantien) zur Verfügung, steigt der Oxidative Stress [7].
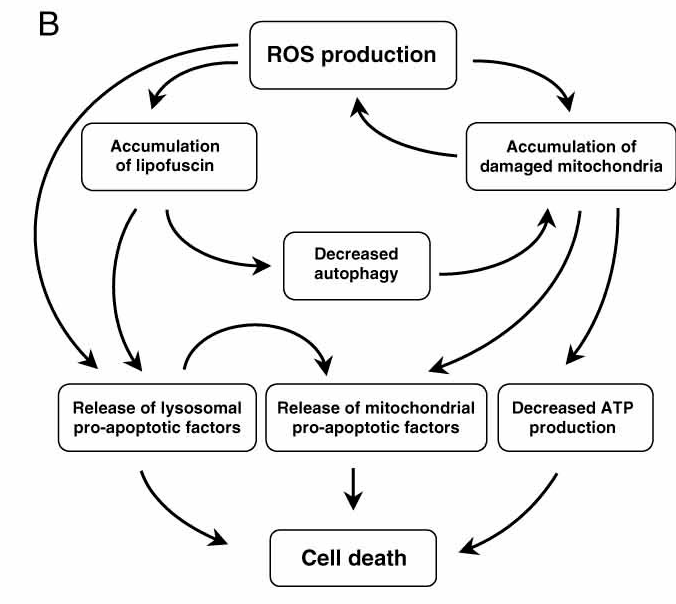
Die vielen Radikale beschleunigen die Lipofuszinbildung in den Lysosomen. Weil der oxidative Stress auch den Mitochodrien selbst schadet, versucht die Zelle, die kaputten Zellkraftwerke durch Autophagozytose zu entsorgen. Dies gelingt ihr jedoch nicht mehr. Und so produzieren die oxidativ geschädigten Mitochondrien immer mehr Radikale. Dieser Teufelskreis kann bis zum programmierten Zelltod (Apoptose) führen (siehe Abbildung unten) [8].
Zu den Hauptursachen von oxidativem Stress zählen die Ernährung und der Lebensstil. Industriell gefertigte Lebensmittel und Fast Food voll mit billigen, ungesättigten Pflanzenölen kurbeln die Radikalproduktion ebenso an wie psychischer und körperlicher Stress, Rauchen, Bewegungsarmut oder Schlafmangel. Auch Umweltgifte wie Abgase oder Pestizide können den oxidativen Stress in den Zellen massiv erhöhen [9].
Die von den freien Radikalen verursachten Schäden summieren sich mit der Zeit, weshalb oxidativer Stress mit einem höheren Lebensalter korreliert. Doch auch junge Menschen können schon signifikante Zellschäden durch freie Radikale aufweisen. Oxidativer Stress gilt als mitursächlich für den Alterungsprozess, chronische Krankheiten und eine geringere Lebenserwartung [7,10].
Nahrungsmittel und Kosmetik aus PUFA
PUFA steht für das englische Wort Polyunsaturated Fatty Acid, also auf deutsch mehrfach ungesättigte Fettsäuren. PUFAs unterscheiden sich von gesättigten Fettsäuren durch ihre chemische Instabilität. Deshalb oxidieren sie besonders schnell und leicht. Wenn Du wissen möchtest, warum ungesättigte Fettsäuren chemisch instabil sind, empfehle ich Dir meinen Artikel Kleine Fettsäurenkunde.
Trifft eine PUFA auf ein Radikal wie zum Beispiel OH oder H2O2, gibt sie eines ihrer Wasserstoffatome (H+) an dieses ab und wird auf diese Weise selbst zum Fettsäure-Radikal. Dieser Prozess, der als Lipidperoxidation bezeichnet wird, löst eine Kettenreaktion aus, bei der sich oxidierte PUFAs fortpflanzen und die Zellen fortlaufend mit Radikalen bombardieren.
Weil PUFAs wie Sonnenblumenöl, Rapsöl oder Sojaöl sehr billig in der Herstellung sind und hohe Gewinnmargen abwerfen, werden Sie im großen Stil in industriell verarbeiteten Lebensmitteln, in der Gastronomie und bei der Herstellung von Kosmetika eingesetzt. Aber auch im Fleisch von Tieren aus Massentierhaltung finden sich sehr viele PUFAs, weil diese mit Soja und Getreide gemästet werden anstatt artgerechtes Futter zu erhalten. Dadurch enthält das Fett dieser Tiere sehr viel mehr PUFAs als das Fleisch wild lebender oder artgerecht gefütterter Tiere.
Wenn wir PUFA-reiche Lebensmittel essen oder uns auf die Haut schmieren, passiert uns dasselbe wie den armen Masttieren – unser Körper baut die instabilen Fettsäuren in unser Struktur- und Depotfett ein. Weil PUFAs unter Lichteinfluss oxidieren (PUFA-Öle müssen im Kühlschrank aufgewahrt werden), zündet das UV-Licht der Sonne eine Radikal-Bombe in der Haut und kurbelt die Lipofuszinbildung an. Menschen, deren Haut mit PUFAs überladen ist, bekommen aus demselben Grund auch sehr leicht einen Sonnenbrand.
Mangel an Antioxidantien
Antioxidantien sind sogenannte Radikalfänger. Sie bilden stabile Verbindungen mit Sauerstoffradikalen und machen sie auf diese Weise unschädlich. Der Körper produziert Antioxidantien, um den oxidativen Stress in den Zellen zu reduzieren. Körpereigene Antioxidantien sind beispielsweise die Superoxid-Dismutase, die das sehr aggressive Superoxid in Wasserstoffperoxid umwandelt oder das Pigment Melanin, das die Haut vor dem oxidativem Stress durch Sonnenstrahlung schützt [11]. Andere – sogenannte exogene – Antioxidantien wie bestimmte Vitamine oder sekundäre Pflanzenstoffe müssen von außen zugeführt werden. Sekundäre Pflanzenstoffe sind nicht nur potente Radikalfänger, sondern sie regen auch die Bildung körpereigener Antioxidantien an. Die Tabelle unten zeigt eine Auswahl körpereigener und exogener Antioxidantien.
| Körpereigene Antioxidantien (Auswahl) | Exogene Antioxidantien (Auswahl) |
|---|---|
| Superoxid-Dismutase Melanin Glutathion Harnsäure Bilirubin Histidin Coenzym Q10 Alpha-Liponsäure |
Vitamin B2 (Riboflavin) und B3 (Niacin) Vitamin E Vitamin C Alpha-/Beta-Karotin Selen Zink Mangan Polyphenole |
Das wichtigste exogene Antioxidans ist Vitamin E. Seine Aufgabe ist es, die in den membranbildenden Lipiden der Zellmembranen enthaltenen PUFAs vor der Lipidperoxidation zu schützen und so Zellschäden zu verhindern. Aus diesem Grund ist Vitamin E Bestandteil aller Membranen menschlicher und tierischer Zellen. Weil Vitamin E nur von photosynthetisch aktiven Organismen wie Pflanzen und Cyanobakterien gebildet wird, muss es mit der Nahrung zugeführt werden. Im Tierversuch führte Vitamin E-Mangel zu einer verstärkten Anhäufung von Liposfuszin in den Zellen [12]
Eine Ernährung, die arm an Antioxidantien ist, führt zu mehr oxidativem Stress und beschleunigter (Haut-)alterung. Die nachfolgende Tabelle zeigt eine Auswahl an natürlichen Lebensmitteln mit einem hohen Gehalt an Antioxidantien.
| Antioxidantien | Vorkommen |
|---|---|
| Vitamin E | Ölsaaten, Walnüsse, Paranüsse, Lebertran, Olivenöl, Schwarzwurzeln |
| Vitamin C | Obst (z. B. Acerola, Kiwi), Zitrusfrüchte, Gemüse (z.B. Paprika, Grünkohl), Kräuter (z. B. Petersilie) |
| Polyphenole (Resveratrol, Flavonoide) |
Kakao, Traubenkernextrakt, rote und blaue Beeren, Rotwein, Kaffee, Grüntee |
| Coenzym Q10 | Öliger Fisch, Fleisch, Eier, Nüsse |
| Selen | Innereien, (Stein-)Pilze, Nüsse, Muscheln, Fisch, Eier, Knoblauch, Zwiebeln |
| Zink | Muscheln (Austern), Ölsaaten, Innereien, Eigelb, Paranüsse, Cashewkerne |
Es kann sinnvoll sein, bestimmte Antioxidantien als Nahrungsergänzungsmittel zu sich zu nehmen – zum Beispiel wenn die Nahrungsmittelauswahl aufgrund von Lebensmittelunverträglichkeiten eingeschränkt ist. Antioxidantien sollten jedoch mit Bedacht eingesetzt werden. Sauerstoffradikale (ROS) sind ein wichtiger Signalgeber für verschiedene interzelluläre Prozesse. Eine Blockade dieser ROS-abhängigen Signalketten führt gleichermaßen zu Gewebeschäden [13].
Eisen
Eisen wird in der Zelle an Ferritin gebunden und so gespeichert, dass es bei Bedarf mobilisiert werden kann. Bei hoher Eisenaufnahme wird die Speicherkapazität des Ferritins überschritten und es kommt zu einem Anstieg der freien Eisen-Ionen Fe2+ und Fe3+. Als Katalysator der Fenton-Reaktion hat Eisen toxisches Potential, da es die Bildung hochreaktiver OH-Radikale ankurbelt [14]. Somit verschiebt freies Eisen die Balance in der Zelle hin zu vermehrtem oxidativem Stress und damit zu einer erhöhten Bildung von Lipofuszin.
Doch damit nicht genug – Freies Eisen wirkt gleichermaßen als Katalysator der Lipidperoxidation. Während die Kettenreaktion der Lipidperoxidation unter physiologischen Bedingungen nach zehn bis 15 Zyklen durch die Reaktion mit Vitamin E zum Erliegen kommt, heizen Eisen-Ionen die Radikal-Produktion erneut an. Bei der Eisen-getriggerten Lipidperoxidation steigt die Anzahl der Fettsäure-Radikale auf ein Vielfaches der ursprünglichen Kettenreaktion. Dabei kann die Zelle so stark beschädigt werden, dass sie abstirbt [15].
Sofern Du keinen Eisenmangel hast, kannst Du die Eisenaufnahme hemmen, indem Du sehr eisenhaltige Lebensmittel wie Leber, rotes Fleisch oder Blutwurst mit Milchprodukten, oxalsäurehaltigem Gemüse oder Kaffee/schwarzem Tee kombinierst. Auch mit Blutspenden lässt sich die Eisenlast wirksam reduzieren. Frauen vor der Menopause verlieren Eisen ganz natürlich über die Regelblutung, sofern sie diese nicht künstlich durch die Einnahme der Pille unterdrücken.
Östrogene
Ein hoher Östrogenlevel sorgt dafür, dass vermehrt Eisen in die Zellen aufgenommen wird. Der gestörte Eisenstoffwechsel erhöht den oxidativen Stress und führt zu den oben bereits beschriebenen Schäden an Mitochondrien und Zellmembranen [16]. Ein Überschuss an Östrogen kann viele Probleme verursachen – eins davon ist die Bildung von Altersflecken.
Akuter und chronischer Stress lassen den Östrogen-Spiegel ansteigen. Dies geschieht über die Aktivierung des Enzyms Aromatase, welches Testosteron in Östrogen umwandelt [17,18]. Weitere Ursachen für zuviel Östrogen sind starkes Übergewicht, hormonelle Verhütungsmittel oder endokrine Disruptoren in Kunststoffen, Pestiziden oder Kosmetikprodukten.
UV-Strahlung
Die von der Sonne produzierte UV-Strahlung begleitet den Menschen seit Anbeginn seiner Entwicklung. Ohne sie hätten wir uns auf der Erde gar nicht entwickeln können. Doch in der modernen Gesellschaft wird die Sonne als schädlich und sogar krebserregend verteufelt. Wie kann das sein?
Sonnenlicht ist der Taktgeber für eine Vielzahl hormonell gesteuerter Abläufe. Wir brauchen die UV-Strahlung der Sonne unter anderem, um das lebenswichtige Vitamin D zu produzieren. Gegen den oxidativen Stress durch UV-Strahlung schützt sich die Haut, indem sie das Antioxidans Melanin bildet [19]. Je mehr eines bestimmten Melanintyps (Eumelanin) die Hautzellen enthalten, desto dunkler die Hautfarbe. Aus diesem Grund haben Menschen, die aus Weltregionen mit starker Sonneneinstrahlung stammen, eine braunere Haut als Menschen aus sonnenärmeren Gegenden.
Auch die Umwelt ist perfekt angepasst. Die Körper von Tieren und Pflanzen in den warmen Regionen der Erde enthalten vor allem gesättigte Fette, während in kalten Regionen ungesättigte Fette vorherrschen. So schützen gesättigte Fettsäuren Kokosnüsse vor Oxidation durch Hitze und UV-Strahlung während ungesättigte Fettsäuren Kaltwasserfische geschmeidig und beweglich halten.
Die UV-Strahlung der Sonne ist also nur dann schädlich für uns, wenn wir Fette konsumieren, die nicht zu unserem Klima passen oder es mit dem Sonnenbaden übertreiben. Dagegen wird die Gefahr, die von künstlichen Lichtquellen ausgeht, von den meisten Menschen vollkommen unterschätzt. Der Blaulichtanteil aus LEDs oder Computerbildschirmen oxidiert die Fettsäuren in unserem Körper sogar noch stärker als das UV-Licht der Sonne [20*].
Sind Altersflecken harmlos?
Weil die braune Pigmentierung der Haut keine spürbaren Beschwerden auslöst, halten die meisten Menschen sie für ein rein kosmetisches Problem. Altersflecken sind jedoch ein Zeichen für vemehrten oxidativen Stress, der sich nicht nur schädlich auf die Haut, sondern auf sämtliche Gewebe des Körpers auswirkt.
Denn Lipofuszin lagert sich nicht nur in Hautzellen, sondern auch in den Nervenzellen des Gehirns, Herzmuskelzellen, Leberzellen, der Netzhaut oder der Nebenniere an. Weil Lipofuzsin zu einem vermehrten Zelltod führt, schrumpfen die betroffenen Organe. Dieser Prozess wird als “braune Atrophie” bezeichnet [21].
Lipofuszinablagerungen in der Netzhaut verursachen die altersbedingte Makuladegeneration. Das Alterspigment findet sich auch in den Ablagerungen der Gefäßwände bei Atherosklerose – allerdings ist nicht geklärt, ob es ursächlich für das Voranschreiten der Krankheit ist oder nur ein Nebenprodukt [22]. Pathologische Lipofuszinanhäufungen werden darüber hinaus mit Krankheiten wie Alzheimer, Parkinson oder COPD in Verbindung gebracht [2,23].
Kann Lipofuszin wieder abgebaut werden?
Weil Lipofuszin von den lysosomalen Enzymen nicht zersetzt werden kann, kann die Zelle das einmal gebildete Lipofuszin nicht mehr durch Exozytose ausleiten. Deshalb lässt sich die zelluläre Alterung auf natürlichem Wege nicht umgekehren, sondern nur durch einen entsprechenden Lebensstil verlangsamen.
Ausgenommen vom Alterungsprozess sind Stammzellen, weil diese sich ein Leben lang teilen können. Denn mit jeder Teilung werden auch die Ablagerungen in der Zelle halbiert. Der Zellmüll wird so stark verdünnt, so dass die produzierten Tochterzellen am Ende quasi frei von Rückständen sind [23]. Aus diesem Grund entwickeln sich aus den Spermien und Eizellen älterer Organismen immer junge Nachkommen.
Wissenschaftliche Studien zeigen, dass sich der Lipofuszin-Gehalt in verschiedenen Geweben mit Hilfe des Wirkstoffs Hydroxypropyl-β-Cyclodextrin reduzieren lässt [24]. Die Behandlung führt jedoch zu schweren Nebenwirkungen [25]. Wir müssen uns also bis auf Weiteres mit dem Altern abfinden. Wie schnell wir altern, können wir jedoch bis zu einem gewissen Grad beeinflussen.
* Als Amazon-Partner verdiene ich an qualifizierten Verkäufen
Quellen
- Hohn A., Grune T. Lipofuscin: Formation, effects and role of macroautophagy. Redox Biol. 2013;1:140–144.
- Wikipedia – Lipofuscin
- Wikipedia – Proteinoxidation
- Wikipedia – Lipidperoxidation
- Schneider, Adrian & Graber, Franziska & Hoppeler, H. (2004). Lipofuszin: «Alterspigment» in der Muskelzelle. Schweizerische Zeitschrift für Sportmedizin. 52. 162-165.
- Wikipedia – Mitochondrium
- Wikipedia – Oxidativer Stress
- Terman A, Gustafsson B, Brunk UT. Autophagy, organelles and ageing. J Pathol. 2007;211(2):134-143.
- https://kresserinstitute.com/what-really-causes-oxidative-damage/
- Bhatti JS, Bhatti GK, Reddy PH. Mitochondrial dysfunction and oxidative stress in metabolic disorders - A step towards mitochondria based therapeutic strategies. Biochim Biophys Acta Mol Basis Dis. 2017;1863(5):1066-1077.
- Lin, Liang-Chuan & Chen, Wei-Tai. (2005). The Study of Antioxidant Effects in Melanins Extracted from Various Tissues of Animals. Asian-Australasian Journal of Animal Sciences. 18. 10.5713/ajas.2005.277.
- Fattoretti P, Bertoni-Freddari C, Casoli T, Di Stefano G, Solazzi M, Corvi E. Morphometry of age pigment (lipofuscin) and of ceroid pigment deposits associated with vitamin E deficiency. Arch Gerontol Geriatr. 2002 May-Jun;34(3):263-8.
- Singh F, Charles AL, Schlagowski AI, Bouitbir J, Bonifacio A, Piquard F, Krähenbühl S, Geny B, Zoll J. Reductive stress impairs myoblasts mitochondrial function and triggers mitochondrial hormesis. Biochim Biophys Acta. 2015 Jul;1853(7):1574-85.
- Schümann, Klaus & Ettle, Thomas & Szegner, Bernadett & Elsenhans, Bernd & Solomons, Noel. (2013). Risiken und Nutzen der Eisensupplementation: Empfehlungen zur Eisenaufnahme kritisch betrachtet. Perspectives in Medicine. 2. 10.1016/j.permed.2013.09.003.
- Mccord, Joe. (2004). Iron, Free Radicals, and Oxidative Injury. The Journal of nutrition. 134. 3171S-3172S. 10.1093/jn/134.11.3171S.
- Bajbouj K, Shafarin J, Abdalla MY, Ahmad IM, Hamad M. Estrogen-induced disruption of intracellular iron metabolism leads to oxidative stress, membrane damage, and cell cycle arrest in MCF-7 cells. Tumor Biology. October 2017.
- Shors, Tracey & Pickett, Jane & Wood, Gwendolyn & Paczynski, Martin. (2000). Acute Stress Persistently Enhances Estrogen Levels in the Female Rat. Stress (Amsterdam, Netherlands). 3. 163-71. 10.3109/10253899909001120.
- Dickens MJ, Cornil CA, Balthazart J. Acute stress differentially affects aromatase activity in specific brain nuclei of adult male and female quail. Endocrinology. 2011 Nov;152(11):4242-51.
- Kalka, K & Mukhtar, Hasan & Turowski-Wanke, A & Merk, Hans. (2000). Biomelanin Antioxidants in Cosmetics: Assessment Based on Inhibition of Lipid Peroxidation. Skin pharmacology and applied skin physiology. 13. 143-9. 10.1159/000029919.
- Leitz A. Fett. Das Handbuch für einen optimierten Stoffwechsel: Warum unser Körperfett ein lebenswichtiges Organ ist. Wie Fettsäuren uns nutzen oder schaden. Welche Rolle Licht und Lebensstil dabei spielen. Herausgeber : Riva Buch*
- Wikipedia – Atrophie
- Perrotta I. Occurrence and characterization of lipofuscin and ceroid in human atherosclerotic plaque. Ultrastruct Pathol. 2018 Nov-Dec;42(6):477-488.
- Family, Fereydoon & Mazzitello, Karina & Arizmendi, Miguel & Grossniklaus, Hans. (2011). Dynamic Scaling of Lipofuscin Deposition in Aging Cells. Journal of Statistical Physics. 144. 332-343. 10.1007/s10955-011-0178-y.
- Gaspar J, Mathieu J, Alvarez P. 2-Hydroxypropyl-beta-cyclodextrin (HPβCD) reduces age-related lipofuscin accumulation through a cholesterol-associated pathway. Sci Rep. 2017;7(1):2197. Published 2017 May 19.
- Wikipedia – Cyclodextrin









Comments powered by Talkyard.