Teilen auf
Twitter Facebook LinkedIn WhatsAppBestimmt hast Du schon einmal den Begriff “Oxidativer Stress” gehört. Aber was ist das eigentlich und woher weiß ich, ob ich oxidativen Stress habe?
Diese Frage ist gar nicht so einfach zu beantworten, denn oxidativer Stress gehört zum Leben wie das Atmen selbst. Womit wir auch schon beim Thema sind. Bei der Zellatmung entstehen Sauerstoffradikale (“Reactive Oxygen Species” – ROS), sauerstoffhaltige Moleküle mit mindestens einem ungepaarten Elektron. Weil sie sehr reaktionsfreudig sind, sind sie potenziell schädlich für die Zelle.
Aber wo Schatten ist, ist ja bekanntlich auch Licht. Denn in kleinen und mittleren Konzentrationen sind ROS wichtige Signalgeber für unsere Zellen und helfen uns, Krankheitserreger abzuwehren. Ein gesunder Körper verfügt zudem über Schutzsysteme, um ROS in Schach zu halten. Welche ROS wir bilden und wofür wir sie brauchen, wann die ROS-Bildung in oxidativen Stress ausartet und wie wir uns dagegen schützen können, erfährst Du in diesem Artikel.
Reaktive Sauerstoffspezies
In der Nomenklatur wird das ungepaarte Elektron mit einem Punkt dargestellt – zum Beispiel Superoxid (O2–•). Superoxid, auch als Hyperoxid bezeichnet, ist so etwas wie die Mutter der Sauerstoffradikale. Trifft ein Superoxid-Molekül in der Zelle auf ein anderes Molekül, können sowohl weniger reaktive (Wasserstoffperoxid) als auch aggressivere Spezies (Hydroxyl, Hydroperoxyl) entstehen.
Superoxid
Unter physiologischen Bedingungen werden etwa 98 Prozent des eingeamteten Sauerstoffs in der Zellatmung zu Wasser reduziert [1]. Aus den restlichen zwei bis drei Prozent molekularem Sauerstoff entstehen durch die Aufnahme je eines Elektrons (1-Elektronen-Reduktion) Superoxid-Radikale (O2–•):
O2 + e- ⟶ O2–•
Superoxid entsteht primär im Enzymkomplex I der Atmungskette. Dabei sorgen zwei Zustände für eine besonders große Radikalproduktion [2]:
- Ein hoher Quotient NADH/NAD+, weil keine Protonen mehr über die mitochondrielle Membran transportiert werden
- Ein hoher Protonengradient Δp über der Membran, weil Elektronen in die Matrix zurückwandern, wenn kein ATP mehr gebildet wird
In beiden Fällen kommt es zu einem Elektronenüberschuss in der Matrix, aus dem große Mengen Superoxid resultieren. Ein defektes Mitochondrium bildet also kaum noch ATP, dafür jedoch umso mehr Sauerstoffradikale.
Daneben führt die Hemmung des Enzymkomplex III zur massiven Bildung von Superoxid-Radikalen in und außerhalb der Matrix [3]. Umweltgifte, die den Komplex III hemmen, sind Antimycin A, das als Piscizid im Fischereimanagement verwendet wird oder Fungizide (Strobilurine), die als Pflanzschutzmittel eingesetzt werden [2],[4*].
Wirkung
Superoxid ist ein potentes Zellgift. Schon in geringen Konzentrationen inaktiviert es das Citratzyklus-Enzym Aconitase, setzt potentiell toxisches Eisen frei und greift die Zellmembranen an [5]. Daher muss es schnell zu Wasserstoffperoxid abgebaut werden.
Abbau
Der Abbau wird durch die Enzymgruppe der Superoxid-Dismutasen (SOD) katalysiert. In der Mitochondrienmatrix ist die Mangan-SOD (SOD2) wirksam, im Membranzwischenraum und im Zytosol ist es die Kupfer-Zink-SOD (SOD1).
Bei normaler SOD-Aktivität haben Superoxid-Radikale eine sehr kurze Halbwertszeit und geringe Reichweite. Steigt die Lebensdauer, kann Superoxid in die Mitochondrienmembran eindringen. Wegen seiner negativen Ladung kann es die Membran jedoch nicht passieren [6]. Mit den Protonen in der Grenzschicht verbindet es sich zu dem aggressiveren Hydroperoxyl-Radikal (HO2•).
Wasserstoffperoxid
Superoxid kann spontan oder enzymatisch katalisiert durch Superoxiddismutase in Sauerstoff und Wasserstoffperoxid (H2O2) zerfallen:
2 O2–• + 2 H+ ⟶ O2 + H2O2
Dabei korreliert die Zerfallsrate mit der Superoxid-Konzentration und der SOD-Aktivität. Denn die Reaktion wird durch das Enzym erheblich beschleunigt. Hohe Konzentrationen an Wasserstoffperoxid hemmen die SOD, genauso wie Chemotherapeutika (Doxorubicin) und Pestitzide [4*,7].
Wirkung
Wasserstoffperoxid zählt zu den ROS, es hat jedoch kein ungepaartes Elektron und ist um Größenordnungen weniger reaktiv als Superoxid. Wasserstoffperoxid hat eine stark oxidierende Wirkung und kann durch Zellmembranen diffundieren, was es zu einem langlebigen und weitreichenden Zellgift macht.
Beispielsweise oxidiert es das Enzym Tyrosinase, das für die Melaninproduktion notwendig ist, und lässt so die Haare ergrauen [8]. In höherer Konzentration führt H2O2 zum programmierten Zelltod (Apotose), weshalb es zum Abtöten von Keimen verwendet wird [9].
Abbau
Der Organismus schützt sich gegen die toxische Wirkung des H2O2 mit den Enzymen Katalase, Glutathion-Peroxidase, Glutathion-S-Transferase und Cytochrom-c-Peroxidase, die es zum ungiftigen H2O und O2 zersetzen [4*]:
2 H2O2 ⟶ 2 H2O + O2
Dieser Prozess wird durch alkalische pH-Werte begünstigt. Schwermetalle wie Quecksilber hemmen die Reaktion, indem sie sich mit der Katalase verbinden und ihre Enzymfunktion irreversibel zerstören [10].
Die Fenton-Reaktion
In Gegenwart der freien Eisenionen Fe2+ und Fe3+ kann die Zersetzung einen anderen Weg nehmen, bei dem Hydroxyl-Radikale (OH•) und Hydroperoxyl-Radikale (HO2•) gebildet werden. Sie wird als Fenton-Reaktion bezeichnet:
Fe2+ + H2O2 ⟶ Fe3+ + OH– + OH•
Fe3+ + H2O2 ⟶ Fe2+ + H++ HO2•
Fe2+ und Fe3+ reichern sich als labiles Plasmaeisen in den Zellen und im Interstitialraum an, wenn die Bindungs- und Speicherkapazität der Zelle für Eisen (Transferrin und Ferritin) überschritten wird – beispielsweise bei einer Eisenüberversorgung oder nach Bluttransfusionen [11]. Eisen ist damit eine wichtiger Auslöser von oxidativem Stress. Fenton-ähnliche Reaktionen finden auch unter Beteilung von Kupfer (Cu2+), Chrom (Cr2+) oder Titan (Ti3+) statt [12].
Die Fenton-Reaktion läuft bei niedrigen pH-Werten besonders effizient ab, daher führt eine Azidose in Blut oder Gewebe häufig zu vermehrtem oxidativen Stress.
Hydroxyl
Hydroxyl (OH•) ist das biologisch aggressivste Sauerstoffradikal. Es entsteht durch die Übertragung eines Elektrons auf Wasserstoffperoxid:
H2O2 + e– ⟶ OH– + OH•
Wirkung
Hydroxyl-Radikale sind sehr reaktiv und können alle Arten von Makromolekülen schädigen: Kohlenhydrate, die DNA (Mutationen), Lipide (Lipidperoxidation) und Aminosäuren [13]. Aus diesem Grund ist Hydroxyl ein sehr potenter Apoptose-Induktor.
Abbau
Im Gegensatz zu Superoxid und Wasserstoffperoxid kann Hydroxyl nicht enzymatisch abgebaut werden. Wegen ihrer sehr kurzen Halbwertszeit (∼10-9 s) und des extrem kleinen Aktionsradius sind Hydroxyl-Radikale jedoch in geringerem Umfang an Zellschädigungen beteiligt als das stabilere Wasserstoffperoxid.
Hydroperoxyl
Etwa 0,3 Prozent des im Zytosol vorhandenen Superoxids liegt in der protonierten Form HOO• beziehungsweise HO2• vor [14]:
O2–• + H+ ⟶ HO2•
Wirkung
Hydroperoxyl greift als Oxidationsmittel die mehrfach ungesättigten Fettsäuren der Biomembranen von Zellen und Zellorganellen an und ist ein wichtiger Initiator der Lipidperoxidation. Zudem kann es Dopamin, Adrenalin, Noradrenalin, Glutathion und andere biologisch aktive Substanzen oxidieren [4*].
Abbau
Organische Peroxyl-Radikale (ROO•) reagieren mit Tocopherol (Vitamin E) nach der Gleichung:
ROO• + Tocopherol-OH ⟶ ROOH + Tocopherol-O•
Diese Reaktion ist elementar für die Unterbrechung von Radikalketten bei der oxidativen Schädigung von Membranfettsäuren. Das dabei entstandene Tocopheroxyl-Radikal muss anschließend durch Reaktion mit anderen Antioxidatien wieder zu Tocopherol reduziert werden [15*].
Nutzen reaktiver Sauerstoffspezies
Sauerstoffradikale sind nicht per se schädlich. Unter physiologischen Bedingungen herrscht in der Zelle ein Gleichgewicht zwischen der Produktion reaktiver Sauerstoffspezies und ihrer Inaktivierung durch Enzyme und Antioxidantien. Diese Balance wird als Redox-Status der Zelle bezeichnet. Der Redox-Status reguliert lebenswichtige Prozesse, die die Funktionalität der Zelle gewährleisten.
ROS als Signalgeber und Enzymregulator
ROS beeinflussen die Aktivität von Enzymen und Transkriptionsfaktoren. Das Prinzip beruht auf Redox-Reaktionen der Thiolgruppe in der Aminosäure Cystein. Eine Thiolgruppe besteht aus einem Schwefel- und einem Wasserstoffatom und wird in der Chemie mit “-SH” beschrieben. Durch Oxidation mit H2O2 wird Cystein-Thiol (CySH) in seine sulfenische Form (CyS-OH) umgewandelt:
CySH + H2O2 ⟶ CyS-OH + H2O
Dieser Redox-Wechsel verändert die Aktivität des betroffenen Proteins.
Die Redox-Reaktion ist reversibel und kann mithilfe der Enzyme Glutaredoxin und Thioredoxin rückgängig gemacht werden: Cys-SOH wird wieder zu Cys-SH und die ursprüngliche Proteinaktivität ist wiederhergestellt (Bild unten).
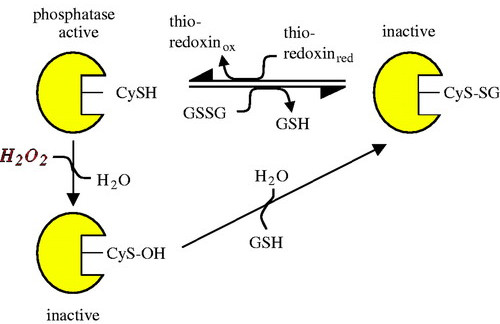
Über den Redoxstatus von Proteinen steuern ROS zelluläre Prozesse wie die Genexpression, die Proliferation und Differenzierung von Zellen, die Immunantwort und den Energiestoffwechsel [17,18].
ROS in der Immunabwehr
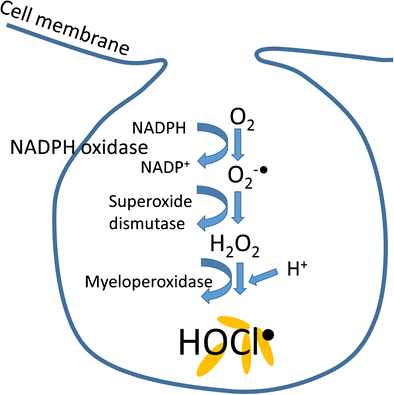
Makrophagen und Neutrophile Granulozyten sind die Fresszellen des unspezifischen Immunsystems. Sie erzeugen große Mengen an ROS, die pathogene Mikroorganismen töten, und können bis zu 100 Bakterien fressen.
Ausgelöst wird die Radikalproduktion von dem Enzym NADPH-Oxidase (NOX). Es befindet sich in den Zellmembranen und ist unter normalen Umständen inaktiv. Sobald die Fresszelle einen Erreger aufnimmt (Phagozytose) kommt es zum Oxidativen Burst – der Sauerstoffverbrauch steigt auf das 50- bis 100-fache an. NOX katalysiert die Reaktion von O2 mit NADPH, aus der Superoxid entsteht:
NADPH + 2 O2 ⟶ NADP+ + 2 O2-• + H+
Das Superoxid wird in den intrazellulären und extrazellulären Raum abgegeben, wo es mithilfe von SOD zu Wasserstoffperoxid (H2O2) abgebaut wird. Wasserstoffperoxid katalysiert mithilfe des Enzyms Myeloperoxidase Chloridionen (Cl–) zu Hypochloriger Säure:
H2O2+ Cl– + H+ ⟶ HOCl• + H2O
Hypochlorige Säure (HOCl•) ist ein starkes Oxidationsmittel mit relativ großer Reichweite. Sie kann Bakterienmembranen zerstören und tötet die phagozytierten Krankheitserreger ab (Bild unten).
Die Sauerstoffradikale greifen nicht nur den Krankheitserreger an, sondern beschädigen auch gesundes Gewebe. Bei einem lokal begrenzten und akuten Entzündungsgeschehen kann der Körper diesen Schaden verkraften. Ist die Entzündungsursache beseitigt, kann das Gewebe regenerieren.
Im Fall einer chronischen Entzündung sind die Immunzellen dauerhaft aktiviert. Das Gewebe steht unter ROS-Dauerbeschuss und degeneriert schließlich. Chronische Entzündungen sind eine Hauptursache für Oxidativen Stress.
Oxidativer Stress
Überschreitet die ROS-Konzentration die antioxidativen Kapazitäten unserer Zellen, leiden wir an oxidativem Stress. Die Radikale breiten sich aus und beschädigen Erbgut, Zellmembranen und Proteine. Oxidativer Stress wirkt zytotoxisch.
Zytotoxische Wirkung
Die Wirkung von Sauerstoffradikalen auf ein Mitochondrium zeigt die untenstehende Abbildung [2]. In kleinen und mittleren Konzentrationen spielen ROS eine wichtige Rolle bei der Signalverarbeitung (“REDOX SIGNALLING”). In hohen Konzentrationen verursachen sie irreversible Schäden, die zur mitochondriellen Dysfunktion und schließlich zum Zelltod (“APOTOSIS”, “NECROSIS”) führen.
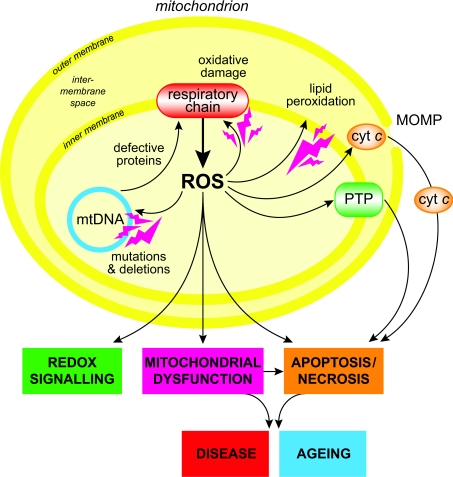
Oxidativer Stress gilt als Ursache vieler Pathologien (“DISEASE”, “AGEING”):
DNA-Schäden
Die DNA der Zelle und insbesondere die DNA der Mitochondrien (mtDNA) reagieren sehr empfindlich auf ROS-induzierte Schäden. Letztere verursachen Strangbrüche oder chemische Veränderungen an den Nukleotiden, die die Kapazität der DNA-Reparatur-Enzyme überschreiten können, so dass Gene mutieren oder ausfallen können. Mutieren Gene, die für die Herstellung von Enzymen zuständig sind, kann die die Fähigkeit der Mitochondrien zur ATP-Synthese und/oder andere Zellfunktionen erheblich eingeschränkt sein. Mutationen an Genen, die das Zellwachstum steuern, können Krebs auslösen [20].
Lipidperoxidaton
Die mehrfach ungesättigten Fettsäuren in den Phospholipiden der Zellmembranen verwandeln sich durch den Kontakt mit ROS in Fettsäure-Radikale (Lipid-Hydroperoxide), die sich immer weiter fortpflanzen. Die Kettenreaktion wird als Lipidperoxidation bezeichnet. Sie wird durch das in den Zellmembranen enthaltene Vitamin E aufgehalten – so lange bis dieses verbraucht ist.
Mit fortschreitender Oxidation verliert die ursprünglich geschmeidige und bewegliche Membran ihre Fluidität. Hierdurch kommen Transportvorgänge und Enzymaktivitäten zum Erliegen [21]. Aus oxidierten Membranfettsäuren entstehen toxische Verbindungen wie Malondialdehyd und 4-Hydroxnoenale. Sie werden mit Krankheiten wie Diabetes, Krebs, Alzheimer oder Atherosklerose in Verbindung gebracht [4*,22,23].
Zelltod
Oxidativer Stress öffnet die sogenannte Permeabilitäts-Transitions-Pore (PTP) der Mitochondrien. Sie macht die Membranen durchlässig für Protonen und kleine Moleküle, so dass der Protonengradient Δp über der inneren Mitochondrienmembran zusammenbricht. Die ATP-Produktion kommt zum Erliegen.
Gleichzeitig befeuert der permeabilitätsbedingte Verlust von Elektronentransportern wie Cytochrom c die Produktion von O2–• in der Atmungskette. Weil auch Antioxidantien wie Glutathion über die Membran verloren gehen, werden weniger ROS neutralisiert [24]. Das Mitochondrium wird zur Radikalenkanone.
Am Ende der Spirale steht der Zelltod durch Apotose oder Nekrose. Sie werden durch unterschiedliche Signalwege ausgelöst: Die Freisetzung von Cytochrom c aus dem Mitochondrium führt zum programmierten Zelltod, während die Aktivierung des Entzündungsmediators TNFα zur Zellnekrose führt [25].
Anzeichen für oxidativen Stress
Chronischer oxidativer Stress tut zunächst einmal nicht weh und läuft bei vielen Menschen unbemerkt im Hintergrund. Als stiller Begleiter zerstört er fortlaufend körpereigenes Gewebe und lässt uns schneller altern. Erst mit der Zeit mehren sich die sichtbaren Zeichen des oxidativen Stresses:
- Graue Haare: ROS hemmen die Pigmentierung der Haare über die Oxidation des melaninbildenden Enzyms Tyrosinase [8]. Je mehr oxidativem Stress ein Mensch ausgesetzt ist, desto schneller ergraut er.
- Falten: Durch Oxidation der Proteine Kollagen und Elastin versteifen die elastischen Fasern des Bindegewebes. Gleichzeitig aktivieren ROS die thiolhaltigen, eiweißabbauenden Enzyme Kollagenase und Elastase, während sie die Enzyme für den Neuaufbau von Strukturproteinen (Antiproteasen) hemmen [4*]. Die Haut wird faltig und dünn.
- Altersflecken: Weil ROS die Lipofuszin-Bildung in den Zellen triggern, bilden sich Altersflecken.
Nicht sichtbar und umso gefährlicher sind die inneren Auswirkungen von oxidativem Stress. Ein Beispiel ist die Atherosklerose des Gefäßsystems.
ROS und Atherosklerose
Endothelzellen bilden die innerste Schicht der Blutgefäße. Über ihre Membranen findet ein selektiver Stoffaustausch bioaktiver Moleküle zwischen dem Blut und den Geweben statt. Steigt die Produktion von ROS in den Endothelzellen, können die Lipid- und Proteinanteile der Membranen oxidieren. Die Membranen verlieren ihre selektive Filterfunktion und werden durchlässig für Lipoproteine niedriger Dichte (LDL = Low Density Lipoprotein) aus dem Blut. LDL transportieren Fette, die wir mit der Nahrung aufgenommen haben. Diese Nahrungsfette können oxidiert sein oder von den ROS in den Endothelzellen oxidiert werden.
Im Inneren der Gefäßwand (Tunica Intima) werden die oxidierten Lipide von den Makrophagen des Immunsystems aufgenommen. Durch die massive Überladung ihres Zytoplasmas mit oxidierten Fetten verwandeln sich die Fresszellen in Schaumzellen, die über die Ausschüttung von Zytokinen weitere Makrophagen anlocken. Durch das Einwandern und die Vermehrung glatter Muskelzellen aus der Muskelschicht (Tunica Media) bildet sich in der Gefäßwand eine fibröse Kappe mit einem weichen Zentrum aus Schaumzellen, nekrotischen Zellen und freiem Cholesterin. Der atherosklerotische Plaque ist entstanden. Er verengt das Gefäß und behindert den Blutstrom (Bild unten).
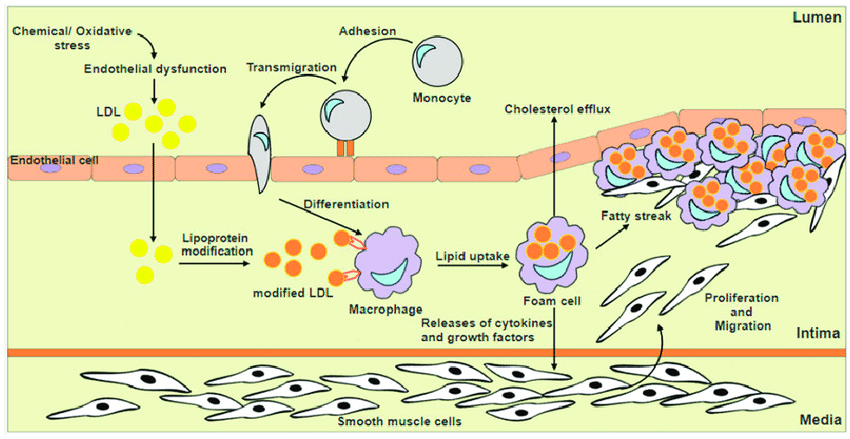
Durch die Einlagerung von Kalzium kommt es im fortgeschrittenen Stadium zur Kalzifizerung der Plaque. Das ehemals elastische Gefäß wird hart und brüchig. Eine häufige Folge sind Erektionsstörungen bei Männern, diese gelten als Vorbote der koronaren Herzkrankheit [27].
Schutz vor oxidativem Stress
Oxidativer Stress ist im Leben unvermeidlich. Denn jede körperliche Anstrengung oder mentale Anspannung lässt den Sauerstoffumsatz ansteigen. Und je mehr Sauerstoff unsere Mitochondrien verbrauchen, desto mehr Superoxid produzieren sie. Der Organismus schützt sich vor Sauerstoffradikalen, indem er mehr antioxidative Enzyme wie SOD bildet. Aus diesem Grund hat regelmäßiger und moderater Sport gesundheitliche Vorteile. Er stärkt die antioxidativen Kapazitäten, so dass wir besser vor oxidativem Stress gewappnet sind [28,29].

Dagegen sind extreme körperliche Belastungen Oxidationsbeschleuniger. Eine im Jahr 2014 veröffentlichte Studie zeigt, dass Marathonläufer signifikant mehr koronare Ablagerungen in Form von nicht verkalkter und verkalkter Plaque aufweisen als sportlich wenig aktive Kontrollpersonen [30]. Trotzdem glauben genug Ahnungslose “Je öfter und härter das Training, umso besser”.
Stress
Egal ob exzessiver Sport, Überarbeitung oder Schlafmangel – chronische Stressbelastungen lassen uns schneller altern. Stress aktiviert die neuronale und endokrine Stressachse, die ihrerseits den oxidativen Stress erhöhen [31,32]. Nachweisbar sind oxidative Schäden z. B. anhand des Biomarkers 8-OHdG. Daneben fördert Stress Entzündungen, was wiederum die Immunzellen aktiviert.
Während akuter Stress nützlich sein kann, macht chronischer Stress krank: Leistungsdruck im Beruf, Lärm, Luftverschmutzung oder elektromagnetische Strahlung. Nimm Dir deshalb regelmäßige Auszeiten, zum Beispiel für einen Spaziergang in der Natur, Entspannungsübungen oder ein heißes Bad an einem kalten Winterabend. Auch ein Umzug oder Jobwechsel kann heilsam sein.
Wenn Du müde bist, dann setz Dich beim Sport nicht unter Druck. Manchmal ist es besser, eine Einheit ausfallen lassen als sich zum Training zu zwingen. Eine längere Regenerationsphase reduziert die ROS-Belastung in den Muskeln und senkt das Risiko für Entzündungen und Verletzungen. Untrainierte und Gelegenheitssportler sollten es langsam angehen lassen. Der Körper braucht Zeit, um seine antioxidative Schutzkapazität aufzubauen. Wer direkt von Null auf Hundert geht, setzt sich massivem oxidativen Stress aus [33].
Ernährung
Seit der Nutzbarmachung von Abfällen aus der Baumwollindustrie Anfang des 20. Jahrhunderts und ihrer Vermarktung als “gesunde pflanzliche Alternative” zu Butter und Schmalz, steigt der Konsum von Pflanzenölen.

Pflanzenöle bestehen hauptsächlich aus mehrfach ungesättigten Fettsäuren (PUFAs) wie Linolsäure. Die zweifach ungesättigte Omega-6-Fettsäure findet sich unter anderem in Sojaöl (49–57 %), Sonnenblumenöl (20–75 %), Kürbiskernöl (18,1–62,8 %), Rapsöl (18–30 %) und Leinöl (12–18 %) [34]. Der Körper integriert PUFAs vorwiegend in die Haut und das Unterhautfettgewebe, wo sie etwa zwei Jahre lang verbleiben [35]. Zwischen 1959 und 2008 nahm die Linolsäure-Konzentration im Unterhautfettgewebe von US-Amerikanern von 9,1 % auf 21,5 % zu. Im selben Maße stieg die Prävalenz von Diabetes, Fettleibigkeit und Asthma [36].
Der Grund: PUFAs sind chemisch extrem instabil. Sie oxidieren im Licht, bei Kontakt mit Sauerstoff und ganz massiv beim Erhitzen. PUFA-Radikale pflanzen sich im Körper fort und verursachen multiple Entzündungen. Oxidiertes LDL aus Omega-6-reichen Pflanzenölen ist daher vermutlich der wichtigste Auslöser von Atherosklerose und koronaren Herzkrankheiten [35]. Gesättigte Fette dagegen schützen das LDL vor dem Oxidieren. Studien zeigen eine Zunahme an Herztoten, wenn gesättigte Fette durch Omega-6-PUFAs ersetzt werden [37].
Was ist mit den essentiellen Omega-3-Fettsäuren?
Der Mensch braucht hauptsächlich die beiden langkettigen Omega-3-Fettsäuren Eicosapentaensäure (EPA) und Docosahexaensäure (DHA). Diese sind vor allem in Kaltwasserfisch, Algen und Produkten von Weidetieren enthalten und in dieser Form auch für den Körper am besten verwertbar. Was der Mensch nicht braucht, sind Leinöl und Fischölkapseln. Leinöl enthält Alpha-Linolensäure, die als Vorstufe von EPA und DHA beworben wird. Doch die Umwandlungsrate im Körper beträgt nur etwa 5 bis 10 % [38]. Fischölkapseln sind – wie Leinöl – bereits oxidiert, bevor Du die Packung oder Flasche aufgemacht hast. So wird am Ende auch Omega-3 zum Treiber der Lipidperoxidation.
Never eat PUFA!

Weil PUFAs extrem billig sind, kommen sie im großen Stil in der Gastronomie, in Großbäckereien und in Fertiggerichten zum Einsatz. Am besten kochst Du also selbst und gewöhnst auch Deine Kinder gar nicht erst an Fast Food und Fertigmüll. Verwende zum Erhitzen gesättigte Fette wie Schmalz, Ghee oder Kokosöl. Diese bestehen überwiegend aus gesättigten Fettsäuren und sind chemisch stabil. Für den Salat eignet sich Olivenöl, dieses enhält hauptsächlich einfach ungesättigte Fettsäuren und oxidiert deutlich langsamer als Sonnenblumenöl und Co.
Rauchen
Ein Zug an der Zigarette befördert etwa 1014 (Sauerstoff-)Radikale in die Lunge [39]. Sie verursachen Zellschäden und aktivieren proteinabbauende Enzyme (Proteasen), die zur Ausbilung eines Lungenemphysems führen können. Zudem enthält Zigarettenrauch Cadmium, Blei, Quecksilber, Eisen und Kupfer. Eisen und Kupfer fördern die Bildung von Hydroxylradikalen über die Fenton-Reaktion, während Blei, Cadmium und Quecksilber den Zellen Thiol-haltige Antioxidantien entziehen und die Aktivität antioxidativer Enzyme herabsetzen können.
Andere Rauchbestandteile verursachen erst nach ihrer Verstoffwechslung oxidativen Stress – zum Beispiel Benzo[a]pyren. Der polyzyklische aromatische Kohlenwasserstoff wird im Körper zu Chinon abgebaut und führt über weitere Stoffwechselreaktionen zur Bildung reaktiver Sauerstoffspezies [40*].
E-Zigaretten gelten als weniger toxisch, aber auch sie erhöhen den oxidativen Stress. Beispielsweise stimuliert das beim Dampfen entstehende Aldehyd Acrolein das Enzym NOX2 in den Immunzellen, woraufhin diese große Mengen an Superoxid und anderen ROS produzieren [41]. Zum Rauchen gibt es daher nicht viel zu sagen, außer dass man es einfach lassen sollte.
Enzyme und Antioxidantien
Der Körper entgiftet ROS auf zwei Arten: Enzyme und Antioxidantien. Beide tun im Prinzip dasselbe – sie “fangen” Radikale und machen sie in einer Redoxreaktion unschädlich. Enzyme werden in der Literatur manchmal auch zu den körpereigenen Antioxidantien gezählt.
Enzyme
Die nachfolgende Tabelle liefert eine Übersicht der ROS-abbauenden Enzyme. Für ihre Herstellung und Aktivierung werden Hilfsstoffe benötigt [4*].
| Enzym | Wirkung | Komponenten/Cofaktoren |
|---|---|---|
| Superoxid-Dismutase | Abbau von Superoxid (O2–•) | Zink, Kupfer (SOD1) Mangan (SOD2) |
| Katalase | Abbau von Wasserstoffperoxid (H2O2) | Häm |
| Glutathion-Peroxidase | Abbau von Wasserstoffperoxid (H2O2) | Glutathion (GSH), Selen |
| Glutathion-S-Transferase | Abbau von Wasserstoffperoxid (H2O2) | GSH |
| Glutathion-Reduktase | Hilfsenzym, reduziert oxidiertes Glutathion (GSSG) wieder zu GSH |
Vitamin B2 (Riboflavin) |
| Cytochrom-c-Peroxidase | Abbau von Wasserstoffperoxid (H2O2) | Cytochrom c |
Aufgrund eines Gen-Polymorphismus ist die manganabhängige SOD2 bei einigen Menschen inaktiv. Die Betroffenen können schlechter mit oxidativem Stress umgehen und leiden häufiger an Erschöpfung und Müdigkeit. Ihr Zustand kann sich durch eine Supplementierung der SOD-Cofaktoren Mangan, Zink und Kupfer verbessern [4*]. Die Aktivität der Glutathion-Peroxidase und der Glutathion-S-Transferase kann ebenfalls beeinträchtigt sein. Die entsprechenden Gen-Polymorphismen sind mit dem Auftreten entzündlicher und neurodegenerativer Erkrankungen assoziiert [42,43].
Antioxidantien
Antioxidantien gliedern sich in endogene Antioxidantien, die der Körper selbst herstellen kann und exogene Antioxidantien. Letztere müssen wir zwingend mit der Nahrung aufnehmen. Zu ihnen gehören Vitamine (außer Vitamin D) und sekundäre Pfanzenstoffe. Manchmal müssen wir auch endogene Antioxidantien ergänzend von außen zuführen.
Die Tabelle zeigt eine Auswahl verschiedener Antioxidantien und ihre Funktion.
| Antioxidans | Fuktion |
|---|---|
| Alpha-Liponsäure | - Reduziert “verbrauchte” Antioxidantien wie Glutathion, Coenzym Q10, Vitamin C und E und stellt so ihre biologisch aktive Form wieder her - Fördert die Ausscheidung von Schwermetallen |
| Vitamin C | - Neutralisiert das bei der Lipidperoxidation verbrauchte Vitamin E (Tocopherol-Radikal) - Wichtig für die Bildung der Kupfer-Zink-SOD |
| Vitamin E | - Schützt die Lipide der Zellmembranen vor Lipidperoxidation |
| Glutathion (GSH) | - Bestandteil des Enzyms Glutathion-Peroxidase, das Wasserstoffperoxid zu Sauerstoff und Wasser abbaut - Neutralisiert das bei der Lipidperoxidation verbrauchte Vitamin C (Ascorbat-Radikal) |
| Mangan | - Bestandteil des Enzyms Mangan-SOD (SOD2), das Superoxid zu Sauerstoff und Wasserstoffperoxid abbaut |
| Selen | - Bestandteil des Enzyms Glutathion-Peroxidase, das Wasserstoffperoxid zu Sauerstoff und Wasser abbaut |
| Coenzym Q10 (Ubichinol) |
Ubichinol ist ein Elektronendonator und daher antioxidativ, während Ubichinon als Elektronenakzeptor die mitochondriale Energieproduktion unterstützt |
| Zink | - Bestandteil des Enzyms Kupfer-Zink-SOD (SOD1), das Superoxid zu Sauerstoff und Wasserstoffperoxid abbaut |
Wie viele Antioxidantien ein Mensch aufnehmen muss, hängt von vielen Einflussfaktoren ab: Genetische Austattung, Gesundheitszustand, Ernährung, Stressbelastung, Umweltgifte, usw… Eine allgemeingültige Empfehlung kann man also nicht abgeben. Allerdings zeigt sich, dass Leistungssportler und chronisch Kranke ihren hohen Bedarf an Antioxidantien in der Regel nur mit hochdosierten Nahrungsergänzungsmitteln decken können [4*,33].
Wie ich mich schütze
Ich habe PUFAs vor zehn Jahren aus meiner Küche verbannt. Zum Braten und Backen verwende ich Butterschmalz und Kokosfett, in den Salat kommt kaltgepresstes Olivenöl. An Antioxidantien nehme ich täglich Vitamin C, Zink und Quercetin ein, außerdem etwa dreimal pro Woche Selen. Wenn ich auswärts essen muss (z. B. auf Reisen), gibt es zusätzlich eine Kapsel Vitamin E.
Auffällig ist, dass meine Haut viel mehr Sonne verträgt als früher. Seit etwa acht Jahren verwende ich fast keine Sonnencreme mehr. Die meisten Sonnencremes enthalten übrigens PUFAs, so wie fast alle Kosmetika. Deshalb bin ich auf der Suche nach PUFA-freien Cremes und Badezusätzen. Wenn Du einen Hersteller weißt, dann schreibe mir bitte. Ich freue mich über jeden Tipp.
* Als Amazon-Partner verdiene ich an qualifizierten Verkäufen
Quellen
- Moser, Ulrich (2010). ANTIOXIDANZIEN – PRO UND KONTRA: Freie Radikale – mehr Schaden als Nutzen?. Schweizer Zeitschrift für Ernährungsmedizin, 5, S. 8-11. Rosenfluh Publikationen AG
- Murphy MP. How mitochondria produce reactive oxygen species. Biochem J. 2009;417(1):1-13
- Muller FL, Liu Y, Van Remmen H. Complex III releases superoxide to both sides of the inner mitochondrial membrane. J Biol Chem. 2004 Nov 19;279(47):49064-73
- Dr. sc. med. Kuklinski J. Mitochondrien: Symptome, Diagnose und Therapie. Herausgeber: Aurum in Kamphausen Media GmbH. Auflage: 3 (2018) Buch*
- https://en.wikipedia.org/wiki/Superoxide_dismutase
- Möller MN, Cuevasanta E, Orrico F, Lopez AC, Thomson L, Denicola A. Diffusion and Transport of Reactive Species Across Cell Membranes. Adv Exp Med Biol. 2019;1127:3-19.
- Karnaukhova TB, Korobova LN, Reĭkh EM. Aktivnost’ superoksiddismutazy kak pokazatel’ toksicheskogo deĭstviia pestitsidov [Superoxide dismutase activity as an index of the toxic action of pesticides]. Nauchnye Doki Vyss Shkoly Biol Nauki. 1990;(5):146-9. Russian. PMID: 2393682.
- https://de.wikipedia.org/wiki/Wasserstoffperoxid
- Ivanovas B, Zerweck A, Bauer G. Selective and non-selective apoptosis induction in transformed and non-transformed fibroblasts by exogenous reactive oxygen and nitrogen species. Anticancer Res. 2002 Mar-Apr;22(2A):841-56. PMID: 12014661
- https://en.wikipedia.org/wiki/Catalase
- Schümann, Klaus & Ettle, Thomas & Szegner, Bernadett & Elsenhans, Bernd & Solomons, Noel. (2013). Risiken und Nutzen der Eisensupplementation: Empfehlungen zur Eisenaufnahme kritisch betrachtet. Perspectives in Medicine. 2. 10.1016/j.permed.2013.09.003.
- https://de.wikipedia.org/wiki/Fenton-Reaktion
- https://en.wikipedia.org/wiki/Hydroxyl_radical
- De Grey AD. HO2*: the forgotten radical. DNA Cell Biol. 2002 Apr;21(4):251-7
- Georg Löffler. Basiswissen Biochemie: mit Pathobiochemie. Herausgeber: Springer Buch*
- Dröge W. Oxidative stress and ageing: is ageing a cysteine deficiency syndrome? Phil. Trans. R. Soc. B 360: 2355–2372
- Poschmann, Gereon & Stuehler, Kai. (2012). Oxidation von Cysteinen: mehr als ein Artefakt der Proteinanalytik. BIOspektrum. 18
- https://de.wikipedia.org/wiki/NF-%CE%BAB
- Stacy, Anderson & Singh, Baljit. (2018). Equine neutrophils and their role in ischemia reperfusion injury and lung inflammation. Cell and Tissue Research. 371
- Wagner A, Jahreis G: Nachweis von DNA-Schäden mittels Analyse von oxidierten Nukleosiden und deren Anwendung als Biomarker. Ernährungs-Umschau 51 (2004); 5: 178–186
- https://www.spektrum.de/lexikon/biologie/membranfluiditaet/42048
- https://de.wikipedia.org/wiki/Malondialdehyd
- https://de.wikipedia.org/wiki/4-Hydroxynonenal
- https://en.wikipedia.org/wiki/Mitochondrial_permeability_transition_pore
- Nele Festjens, Tom Vanden Berghe, Peter Vandenabeele. Necrosis, a well-orchestrated form of cell demise: Signalling cascades, important mediators and concomitant immune response. Biochimica et Biophysica Acta (BBA) - Bioenergetics, Volume 1757, Issues 9–10, 2006, Pages 1371-1387
- Ooi, Bee Kee & Goh, Bey Hing & Yap, Wei Hsum. (2017). Oxidative Stress in Cardiovascular Diseases: Involvement of Nrf2 Antioxidant Redox Signaling in Macrophage Foam Cells Formation. International Journal of Molecular Sciences. 18. 2336
- https://www.maennergesundheit.info/erektionsstoerungen/ursachen/organisch/gefaesskrankheiten.html
- Carlsohn A, Rohn S, Bittmann F, Raila J, Mayer F, Schweigert F, J: Exercise Increases the Plasma Antioxidant Capacity of Adolescent Athletes. Ann Nutr Metab 2008;53:96-103
- Yatabe K, Muroi R, Kumai T, Kotani T, Somemura S, Yui N, Murofushi Y, Terawaki F, Kobayashi H, Yudoh K, Sakurai H, Miyano H, Fujiya H. Effects of Different Exercise Conditions on Antioxidant Potential and Mental Assessment. Sports. 2021; 9(3):36
- Schwartz RS, Kraus SM, Schwartz JG, et al. Increased Coronary Artery Plaque Volume Among Male Marathon Runners. Mo Med. 2014;111(2):89-94
- Aschbacher K, O’Donovan A, Wolkowitz OM, Dhabhar FS, Su Y, Epel E. Good stress, bad stress and oxidative stress: insights from anticipatory cortisol reactivity. Psychoneuroendocrinology. 2013 Sep;38(9):1698-708. doi: 10.1016/j.psyneuen.2013.02.004. Epub 2013 Mar 13. PMID: 23490070; PMCID: PMC4028159
- Black CN, Bot M, Révész D, Scheffer PG, Penninx B. The association between three major physiological stress systems and oxidative DNA and lipid damage. Psychoneuroendocrinology. 2017 Jun;80:56-66. doi: 10.1016/j.psyneuen.2017.03.003. Epub 2017 Mar 6. PMID: 28319849
- https://www.loges.de/ratgeber/oxidative-belastung-im-ausdauersport
- https://de.wikipedia.org/wiki/Linolsäure
- DiNicolantonio JJ, O’Keefe JH. Omega-6 vegetable oils as a driver of coronary heart disease: the oxidized linoleic acid hypothesis. Open Heart 2018;5:e000898
- Guyenet SJ, Carlson SE. Increase in adipose tissue linoleic acid of US adults in the last half century. Adv Nutr. 2015 Nov 13;6(6):660-4
- Ramsden CE, Zamora D, Leelarthaepin B, Majchrzak-Hong SF, Faurot KR, Suchindran CM, Ringel A, Davis JM, Hibbeln JR. Use of dietary linoleic acid for secondary prevention of coronary heart disease and death: evaluation of recovered data from the Sydney Diet Heart Study and updated meta-analysis. BMJ. 2013 Feb 4;346:e8707
- Burdge, Graham & Jones, Amanda & Wootton, Stephen. (2002). Eicosapentaenoic and docosapentaenoic acids are the principal products of linolenic acid metabolism in young men. The British journal of nutrition. 88. 355-63. 10.1079/BJN2002662
- https://www.spektrum.de/lexikon/biologie/freie-radikale/25601
- Halliwell, Barry B., Poulsen, Henrik E. Cigarette Smoke and Oxidative Stress. Herausgeber: Springer (2006) Buch*
- https://www.aerztezeitung.de/Medizin/E-Zigarette-Gefahr-fuer-Lunge-Herz-und-Hirn-403892.html
- https://de.wikipedia.org/wiki/Glutathionperoxidase
- https://en.wikipedia.org/wiki/Glutathione_S-transferase








Comments powered by Talkyard.