Teilen auf
Twitter Facebook LinkedIn WhatsAppChronische Übersäuerung – Für die einen ist sie ein pseudowissenschaftlicher Mythos, für andere ein ernstes Gesundheitsproblem. Wer hat recht?
Das Konzept der „Chronischen Übersäuerung” findet in der Schulmedizin wenig Beachtung, schließlich bleibt der pH-Wert des Blutes bei jeder Ernährung gleich. Ganz anders ist es in der Naturheilkunde. Dort gilt die Säurelast als Treiber von Zivilisationskrankheiten wie Diabetes, Osteoporose und Krebs.
Das wissenschaftliche Interesse am Säuren-Basen-Haushalt des Körpers hat in den letzten Jahren stark zugenommen. Forschungsergebnisse belegen, dass Übersäuerung ein real existierendes Phänomen ist. In neueren Studien ist sie mit Insulinresistenz, Infektionskrankheiten, Osteoporose, Allergien, Autoimmunkrankheiten und Krebs assoziiert. Ob und wann diese Erkenntnisse in der schulmedizinischen Praxis ankommen, steht allerdings in den Sternen.
Auch ich stand dem Thema „Chronische Übersäuerung” lange Zeit skeptisch gegenüber. Nach umfassender Recherche habe ich meine Meinung geändert. In diesem Artikel erkläre ich, wie der Stoffwechsel das Säure-Basen-Gleichgewicht beeinflusst und warum wir die Folgen der Säurelast erst nach vielen Jahren bemerken. Ich stelle Diagnosemöglichkeiten vor und gebe Tipps, wie Du überschüssige Säuren wieder loswerden kannst.
Der Säure-Basen-Haushalt
Eine Säure ist ein Molekül, das ein oder mehrere Protonen (H+) abgeben kann. Eine Base kann Protonen aufnehmen und so die Säure neutralisieren. Die wichtigste Base ist das Hydroxid-Ion (OH–). Bei einem Säureüberschuss überwiegen folglich die H+, bei einem Basenüberschuss die OH–.

Der pH-Wert ist ein Maß für die H+-Konzentration in einer wässrigen Lösung. Der pH = 7 entspricht einer neutralen Lösung (z. B. Wasser), pH-Werte < 7 sind sauer, pH-Werte > 7 sind basisch (Bild oben).
Physiologische pH-Werte
Als Säure-Basen-Haushalt bezeichnet man in der Medizin das Verhältnis von Säuren und Basen im Körper, also im Blut, in in der interstitiellen Flüssigkeit, im Gewebe und im Zytosol der Körperzellen:
- Die interstitielle Flüssigkeit und das Gewebe eines gesunden Menschen sind leicht alkalisch mit pH-Werten zwischen 7,4 und 7,7.
- Die Zellflüssigkeit ist in etwa neutral (pH = 6,9 – 7,2).
- Der pH-Wert des Blutes schwankt zwischen 7,35 und 7,45 [1*].
Bei einem Blut-pH < 7,35 oder > 7,45 treten schwerwiegende Stoffwechselstörungen auf, die im Extremfall zum Tod führen. Dies wird verständlich, wenn wir uns die allgemeine Struktur von Aminosäuren ansehen.
Aminosäuren sind die Bausteine der Proteine. Sie bestehen aus einem zentralen Kohlenstoffatom (C), einem Wasserstoffatom (H), einer Aminogruppe (H3N+), einer Carboxylgruppe (COO–) und einer variablen Seitenkette (R) (Bild unten).
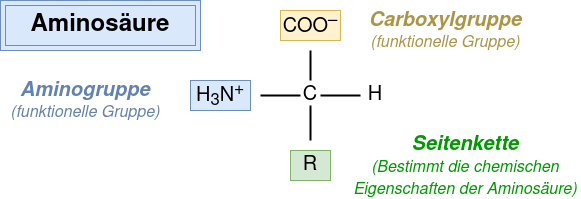
Die Seitenkette bestimmt die spezifischen Eigenschaften der Aminosäure. Die Aminogruppe kann ein Proton abgeben und die Carboxylgruppe ein Proton aufnehmen. Aminosäuren verhalten sich damit wie Säuren und Basen (Ampholyte). Befindet sich eine Aminosäure in einer zu sauren oder zu basischen Lösung, verschieben sich ihre Ladungen. Infolgedessen können Blutproteine, Enzyme und Hormone denaturieren und so ihre Funktion verlieren.
Woher kommen die Säuren und Basen?
Im Stoffwechsel werden permanent Säuren und Basen gebildet und verbraucht. Die nachfolgende Tabelle fasst einige der wichtigsten säure- und basenbildenden Stoffwechselprozesse zusammen.
| Stoffwechselprozess | Beschreibung | Organe | Säure-Basen-Effekt |
|---|---|---|---|
| Aminosäuren-Abbau (Harnstoffzyklus) |
Durch Freisetzung der Aminogruppe entsteht Ammoniak (NH3). Dieser wird zu 95 % im Harnstoffzyklus abgebaut. Dabei wird pro Molekül NH3 ein Molekül der Base HCO3– verbraucht. | Leber | sauer (OH– verbraucht) |
| Abbau von Cystein und Methionin (Eliminierende Desaminierung) |
Schwefelhaltige Aminosäuren werden zu Schwefelsäure (H2SO4) oxidiert, die in Sulfat (SO42–) und Protonen zerfällt. | Leber | sauer (H+ freigesetzt) |
| Abbau von Phosphoproteinen (z. B. Pepsin, Ovalbumin) |
Phosphoproteine sind Proteine, die an eine Phosphorsäure-haltige Substanz gebunden sind. Beim Abbau wird die Säure frei. | Leber | sauer (H+ freigesetzt) |
| Anaerobe Glykolyse (Milchsäure-Gärung) |
Unter anaeroben Bedingungen entsteht aus Pyruvat das saure Stoffwechselprodukt Laktat: Pyruvat + NADH + H+ ⟶ Laktat + NAD+ |
Schnell kontrahierende Skelettmuskeln, rote Blutkörperchen, schlecht vaskularisierte Gewebe wie Kornea, Augenlinse und Nierenmark [2] | sauer (H+ freigesetzt) |
| DNA-Abbau | Der Abbau Purin-haltiger Nukleinbasen führt zu Harnsäure | Leber, Dünndarm | sauer (H+ freigesetzt) |
| Abbau von Mineralsalzen aus der Nahrung (z. B. Kalziumcitrat, Magnesiumlaktat, Kaliummalat) |
Im wässrigen Milieu zerfallen die Salze in Kationen (Ca2+, Mg2+, K+) und Anionen (Citrat3–, Laktat–, Malat2–). Beim Abbau der Anionen werden OH– gebildet [3]. | Leber, Dünndarm | basisch (OH– erzeugt) |
Bei den meisten Menschen überwiegt die Säurebildung. Wichtigster Einflussfaktor ist die Ernährung. Aus den aufgenommenen Nährstoffen entstehen bei der Verstoffwechselung erhebliche Mengen an Säure- und Basenäquivalenten. Entscheidend ist nicht, wie viel Säure wir mit einer einzelnen Mahlzeit aufnehmen, sondern die Gesamtheit der über einen längeren Zeitraum resorbierten Stoffe.
Um Schwankungen im Säure-Basen-Haushalt auszugleichen, verfügt der Körper über mehrere Puffersysteme.
Der Blutpuffer
Der Bicarbonat-Puffer (auch Hydrogencarbonat-Puffer) stabilisiert den pH-Wert des Blutes. Es handelt sich um ein offenes System, bei dem Säuren über die Atemluft und den Urin ausgeschieden werden. Mit 53 % der gesamten Pufferkapazität ist er das wichtigste Puffersystem des Körpers [4]. Maßgeblich für seine Funktion ist das Zusammenspiel zwischen Lunge und Niere.
Respiratorische Regulation (Lunge)
Bei der Energieproduktion in den Zellen entsteht Kohlendioxid (CO2). 90 % des CO2 reagieren mit Wasser zu Kohlensäure (H2CO3), welche im wässrigen Milieu des Blutes in Bicarbonat (HCO3–) und H+ zerfällt [3]:
CO2 + H2O ⇌ H2CO3 ⇌ HCO3– + H+
H+ und HCO3– bilden ein konjugiertes Säure-Basen-Paar. Das Verhältnis von H+ und HCO3– im Blut ist nicht kontant, sondern schwankt abhängig von Stoffwechsellage und Nahrungszufuhr. Das normale Verhältnis zwischen Bicarbonat und Kohlensäure beträgt 20 : 1. Bei einem Säureüberschuss (Azidose) entsteht mehr Kohlensäure. Die H+ kombinieren in der Lunge mit HCO3– und das entstandene Kohlendioxid wird mit dem Atem ausgeschieden [5] (Bild unten).
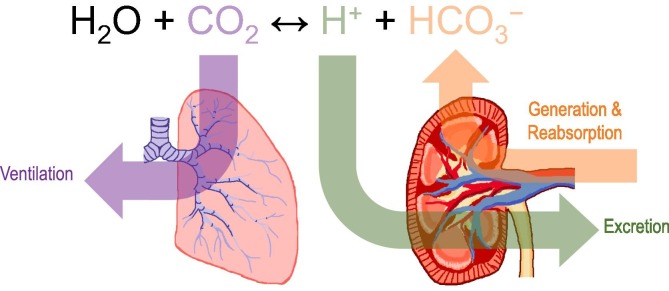
Reguliert wird die Atemaktivität vom Atemzentrum des autonomen Nervensystems. Ein prominentes Beispiel ist die Kußmaul-Atmung. Dabei handelt es sich um eine tiefe, rhythmische Atmung zur Kompensation der Ketoazidose bei Insulinmangel. Umgekehrt erhöht eine zu flache Atmung, bei der viel CO2 im Körper verbleibt, die Säurelast [7].
Metabolische Regulation (Niere)
Neben Kohlensäure bildet der Stoffwechsel nicht-flüchtige Säuren wie Harnsäure, Schwefelsäure oder Phosphorsäure. Weil diese nicht in einen gasförmigen Zustand übergehen können, müssen sie über die Nieren ausgeschieden werden. Auch der Bicarbonat-Gehalt des Blutpuffers wird über die Nieren reguliert. Dies geschieht auf zwei Arten:
- Ausscheidung von Säuren ⇒ Erhöhung des Bikarbonatgehalts im Blut
- Ausscheidung von Basen ⇒ Senkung des Bikarbonatgehalts im Blut
Insgesamt kann eine gesunde Niere pro Tag bis zu 1 Mol (≈ 6 · 1023) Protonen ausscheiden [3]. Mit jedem ausgeschiedenen H+ resorbiert bzw. erzeugt sie ein HCO3–-Ion, wodurch sich der Anteil an Basen im Bicarbonat-Puffer erhöht.
Die renale Säure-Basen-Regulierung basiert auf vier Mechanismen:
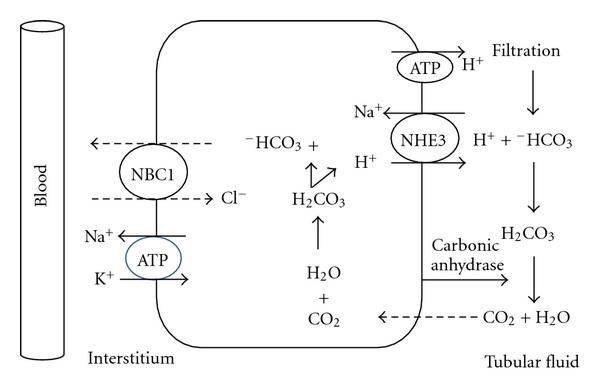
1. Reabsorption von Bicarbonat aus dem Primärharn
Das membranständige Transportprotein NHE3 verschiebt H+ aus der Nierenzelle in den Nierentubulus, wo sie mit HCO3– zu Kohlensäure reagieren. Im Nierentubulus spaltet das Enzym Carboanhydrase die Kohlensäure in Wasser und Kohlendioxid. CO2 diffundiert zurück in die Nierenzelle, wo es zur Produktion von Bicarbonat verwendet wird. Das Bicarbonat wird mithife des Transportproteins NBC1 ins Blut transportiert (Bild unten).
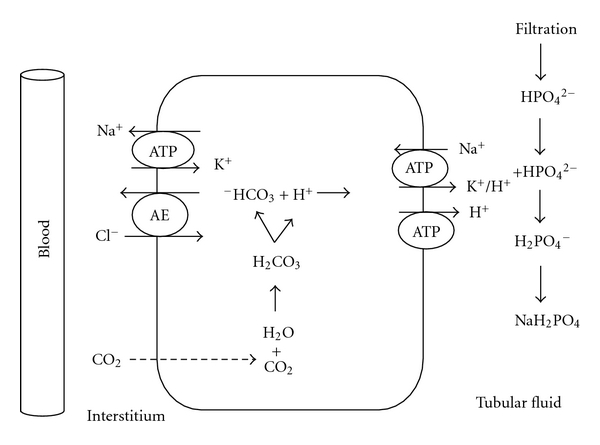
2. Ausscheidung titrierbarer Säuren
Ein großer Teil der in den Tubulus freigesetzten H+ kombiniert im Primärharn mit ausscheidungspflichtigen Anionen wie Phosphat, Sulfat und Urat zu Phosphorsäure, Schwefelsäure und Harnsäure. Für jedes ausgeschiedene Anion wird in der Nierenzelle ein neues HCO3– gebildet und ins Blut transportiert (Bild unten).
Aufgrund des Säuregehalts verschiebt sich Urin-pH-Wert in den sauren Bereich. Er darf jedoch nicht unter pH = 4,5 sinken, da sonst die Eiweiße der Nierentubuli degenerieren [3]. Die Menge an H+, die als titrierbare Säuren ausgeschieden werden können, ist entsprechend limitiert. Fallen sehr viele H+ an, muss der Urin-pH über das Ammoniak/Ammonium-System gepuffert werden.
3. Ausscheidung von Ammoniak/Ammonium
Die Produktion von Ammoniak (NH3) aus dem Abbau der Aminosäure Glutamin ist der Hauptweg der Säureausscheidung. NH3verbindet sich mit H+ zu Ammonium (NH4+), welches mit dem Harn ausgeschieden wird. Für jedes ausgeschiedene H+ wird ein HCO3– neu gebildet (Bild unten).
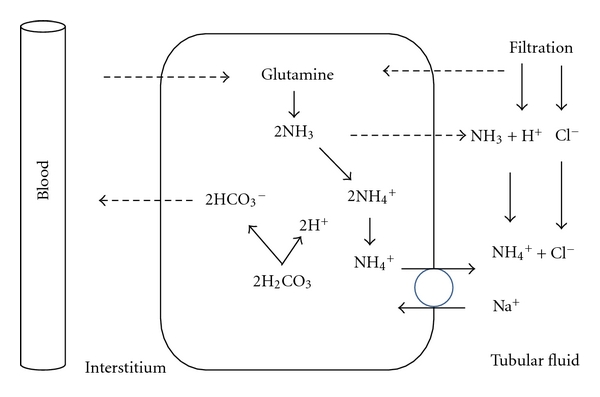
Die Pufferwirkung beruht auf dem Verhältnis von NH4+ (schwache Säure) zu NH3 (starke Base) im Tubulus. Unter basalen Bedingungen scheiden die Nieren 50 bis 70 % aller H+ in Form von Ammonium aus.
Der Ammonium-Puffer ist sehr anpassungsfähig: Bei einer azidotischen Stoffwechsellage steigt die NH4+-Produktion auf ein Vielfaches. 80 bis 90 % der überschüssigen Säuren werden dann als Ammonium ausgeschieden [9,10].
Bei einem Glutaminmangel können die Nieren nicht genug NH3 produzieren. Als Kompensation steigt die Ausscheidung titrierbarer Säuren. In der Folge kann der pH-Wert im 24-Stunden-Urin unter 5,4 fallen. Hierdurch kann es bei vulnerablen Personen zu Nierenschäden kommen [3].
4. Ausscheidung von Basen
Bei einem Basenüberschuss (Alkalose) scheiden die Nieren vermehrt Bicarbonat aus. Das Transportprotein Pendrin verschiebt ein HCO3– in den Tubulus und nimmt im Gegenzug ein Chlorid-Ion (Cl–) in die Nierenzelle auf (Bild unten).
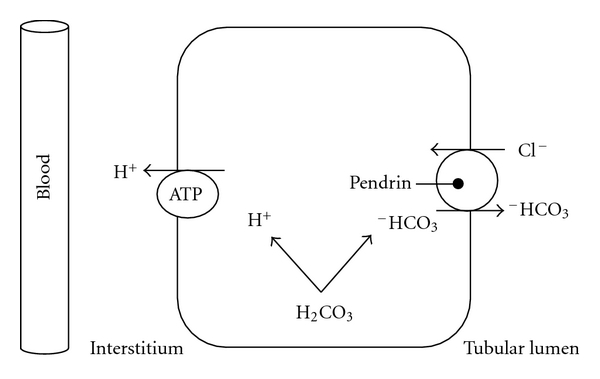
Abhängig von der Ernährung, der körperlichen Belastung und der Stoffwechselaktivität wechselt ein gesunder Mensch zwischen Säureflut und Basenüberschuss. Entsprechend schwankt der pH-Wert des Urins im Tagesverlauf zwischen 4,5 und 8,2.
Ein anhaltender Säure- bzw. Basenüberschuss fördert die Expression der renalen Transportproteine NHE3 und NBC1 (Azidose) bzw. Pendrin (Alkalose). Deshalb benötigen die Nieren mehrere Stunden bis Tage, um die Ausscheidung von Säuren und Basen an die Stoffwechsellage anzupassen [8].
Geschlossene Puffersysteme
Außer dem Bicarbonat-Puffer gibt es im Blut drei weitere Puffersysteme. Weil die Reaktionspartner nicht aus dem Körper entweichen können, bilden sie geschlossene Systeme. Ihr Anteil am Gesamtpuffer beträgt knapp 50 % [4].
Das wichtigste geschlossene Puffersystem des Blutes ist der Hämoglobin-Puffer in den Erythrozyten. Der rote Blutfarbstoff besteht zu einem großen Teil aus der Aminosäure Histidin, deren Seitenkette H+ aufnehmen und abgeben kann. Wegen der großen Zahl roter Blutkörperchen hat der Hämoglobin-Puffer einen Anteil von etwa 35 % an der Gesamtpufferkapazität [4].
Die Blutproteine bilden den Plasmaprotein-Puffer. Bei niedrigen pH-Werten können ihre Carboxylgruppen H+ aufnehmen und bei hohen pH-Werten können ihre Aminogruppen H+ abgeben. Die Abbildung unten zeigt die verschiedenen Bindungszustände am Beispiel der Aminosäure Alanin [11*].
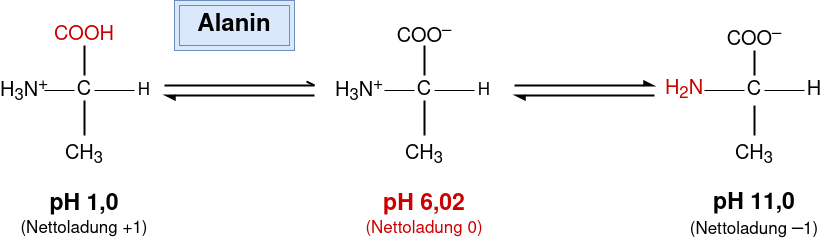
Als Pufferproteine dienen praktisch alle Plasmaproteine, allen voran Albumin, weil es das am höchsten konzentrierte Protein im Blut ist. Der Plasmaprotein-Puffer umfasst etwa 7 % der Gesamtpufferkapazität [4].
Mit einem Anteil von 5 % ist der Phosphatpuffer der kleinste Puffer im Blut [4]. Phosphate sind Anionen aus Wasserstoff, Phosphor und Sauerstoff, die H+ aufnehmen bzw. abgeben können. Bei pH ≈ 7,4 bilden Phosphate das nachfolgende Pufferpaar:
H2PO4– + H2O ⇌ H3O+ + HPO42–
Wichtiger als im Blut ist der Phosphatpuffer in den Zellen, wo Phosphat an der Energieproduktion beteiligt ist. Darüber dient Phosphat als Urinpuffer bei der Ausscheidung titrierbarer Säuren.
Chronische Übersäuerung
Schulmedizinisch steht der Begriff Übersäuerung für die akute Metabolische Azidose – einen raschen Abfall des Blut-pH-Wertes unter 7,35 (Azidämie) infolge einer Stoffwechselanomalie. Ursache kann z. B. eine Ketoazidose (Insulinmangel), eine Laktatazidose (Sauerstoffmangel) oder eine Niereninsuffizienz (geringe Säureausscheidung/hoher Bicarbonatverlust) sein. Es handelt sich um medizinische Notfälle, welche unbehandelt schnell zum Tode führen.
Davon abzugrenzen ist die chronische Übersäuerung, um die es in diesem Artikel geht. Sie bechreibt einen geringfügigen und dauerhaften Säureüberschuss, bei dem der Blut-pH-Wert auf Kosten der Körpersubstanz aufrechterhalten wird. Meist bewegt er sich im unteren Normalbereich (pH < 7,42). Die Übersäuerung betrifft vielmehr die extrazelluläre Matrix und die interstitielle Flüssigkeit, die das Gewebe umgibt. Die Folgen der chronischen Übersäuerung machen sich erst nach Jahren oder Jahrzehnten bemerkbar.
Säure frisst Körpersubstanz
Um den Blut-pH-Wert trotz Säureüberschuss im normalen Bereich zu halten, müssen die Nieren sehr viele Säuren ausscheiden. Das passiert vor allem auf dem Ammoniak/Ammonium-Weg, wobei die Nieren sehr viel Glutamin verbrauchen. Der größte Glutaminspeicher im Körper ist die Muskulatur. Eine chronische Azidose wird deshalb zuerst vom Muskelgewebe abgepuffert [12.13].
Verlust von Muskelmasse
Um Glutamin aus den Muskelproteinen herauszulösen, wird das in den Muskelzellen lokalisierte proteinabbauende Ubiquitin-Proteasom-System aktiviert. Dieser Prozess korreliert mit einer verstärkten Cortisolausschüttung. Die Skelettmuskulatur wird abgebaut, langfristig steigt der Verlust von Muskelmasse. Zwar können wir dem Muskelabbau durch Krafttraining entgegenwirken, Muskelaufbau und Regeneration finden aber nur reduziert statt [3,12].
Ist die renale Ausscheidungskapazität ausgeschöpft, werden H+ vom Blut in die interstitielle Flüssigkeit verschoben, um den pH-Wert des Blutes aufrecht halten zu können. Die Gewebeflüssigkeit verteilt die Säuren im Körper, wo sie von Bindegewebe, Knochen und Körperzellen abgepuffert werden (Bild oben).
„Verschlackung” des Bindegewebes
Bindegewebe besteht zu einem großen Teil aus Proteoglykanen. Dabei handelt es sich um Proteine mit Seitenketten aus langkettigen Kohlenhydraten. Die Enden der Seitenketten sind negativ geladen (Bild unten).
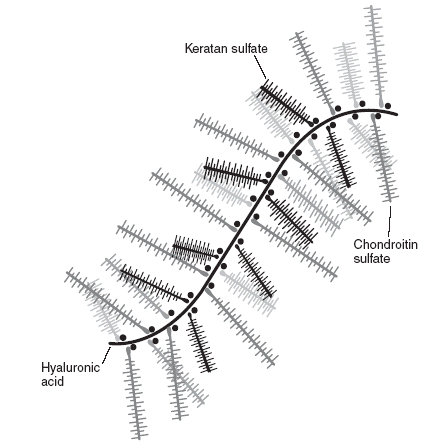
Wegen ihrer negativen Ladung können Proteoglykane sehr viele Wassermoleküle an sich binden und sich mit anderen Bindegewebsstrukturen vernetzen. Das gespeicherte Wasser macht das Bindegewebe flexibel und elastisch.
Bei einer Gewebsazidose hängen sich die überschüssigen H+ an die negativ geladenen Enden der Proteoglykane. Hierdurch brechen Quervernetzungen auf und die Wasserbindungskapazität nimmt ab. Dieser alternativmedizinisch als „Verschlackung” bezeichnete Prozess beeinträchtigt die Nährstoffversorgung und macht Bänder, Sehnen und Knorpel spröde [13].
Verlust von Knochensubstanz
Der Knochen speichert organische Salze wie Kalziumphosphat, Kalziumcarbonat, Kalziumchlorid und Magnesiumphosphat. 99 % des Kalziums, 86 % des Phosphats und 45 % des gesamten körpereigenen Natriums befinden sich in den Knochen [15,16].
In einem sauren Milieu setzt der Knochen Kalziumcarbonat frei. Kalzium (Ca2+) wird über den Urin ausgeschieden, das Carbonat dient als Säurepuffer. H+ ersetzen Natrium (Na+) und Kalium (K+) in der Knochenoberfläche. Durch den Mineralienverlust verliert der Knochen an Festigkeit (Osteomalazie) [3,17].
Außerdem binden H+ an OGR1-Rezeptoren auf den Knochenzellen. Hierdurch werden die Osteoblasten gehemmt und die Osteoklasten aktiviert:
- Die Hemmung der Osteoblasten reduziert den Aufbau der kollagenhaltigen Knochenmatrix, welche das Grundgerüst der Knochen bildet.
- Die Stimulation der Osteoklasten führt zur Auflösung der Knochenmatrix und beschleunigt die Demineralisierung. Langfristig steigt das Risiko für Osteoporose [3,17].
Osteoporose fördert Knochenbrüche, insbesondere am Oberschenkelhals, den Wirbeln und Handgelenken. Osteomalazie äußert sich durch dumpfe Knochenschmerzen. Wegen des gestörten Knochenstoffwechsels kommt es zu Verformungen und Bewegungseinschränkungen (Bild unten).
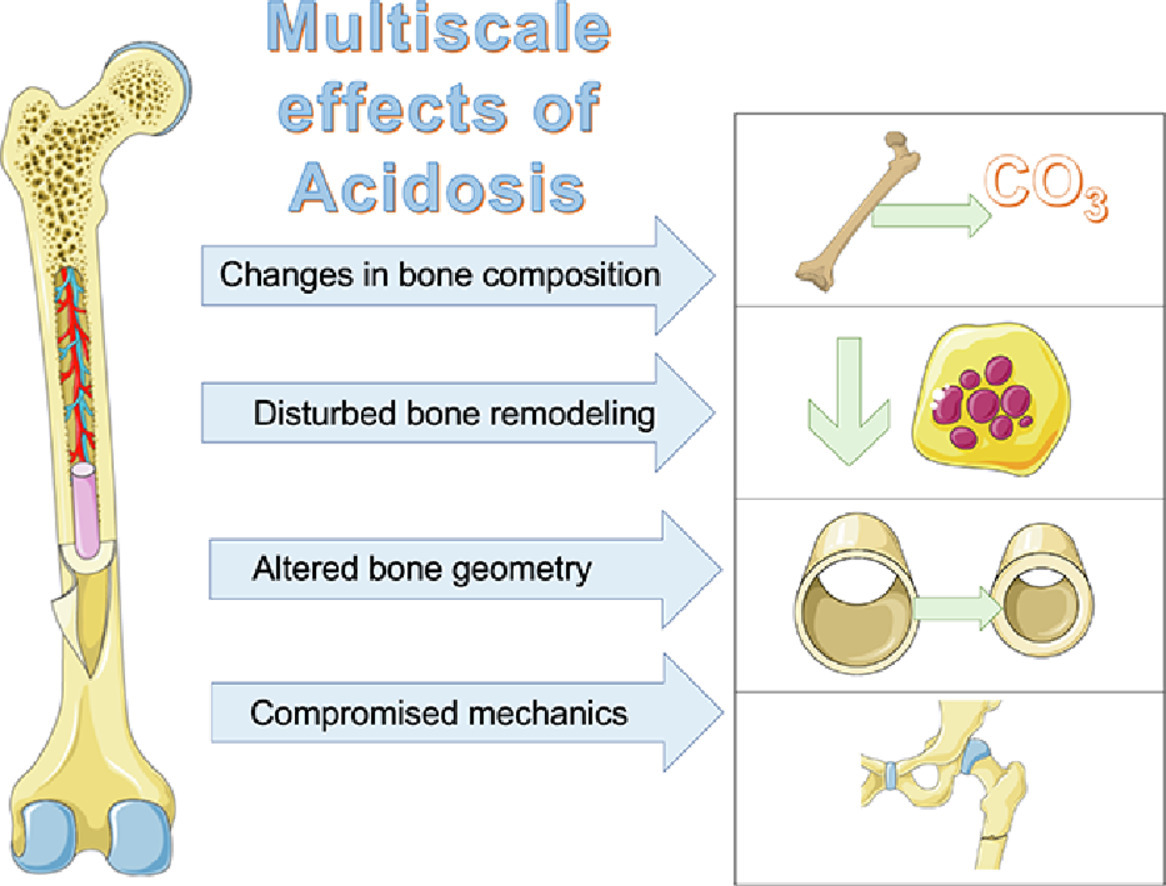
Chronische Übersäuerung macht sich zunächst meist durch die Demineralisierung von Haaren, Nägeln und Zähnen bemerkbar. Wegen des hohen Ca2+-Spiegels im Blut kommt es zur Kalzifikation von Blutgefäßen, Organen und gelenknahen Weichteilen (z. B. Kalkschulter).
„Saure” Zellen
Die Zellflüssigkeit ist normalerweise leicht alkalisch (pH ≈ 7,1) und reich an Kalium. In einem sauren Milieu kommt es zum Ionenaustausch: H+ dringen in die Zelle ein und K+ strömen hinaus. Gleichzeitig wird weniger Kalium in die Zelle aufgenommen. In der Folge sinkt der zytosolische pH-Wert (Bild unten).
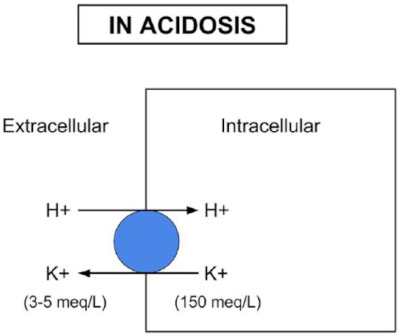
Weil 98 % des körpereigenen Kaliums in den Zellen gespeichert sind, steigt das Serumkalium schnell an. Eine schwere Azidose geht daher stets mit einer Hyperkaliämie einher. Hohe extrazelluläre K+-Spiegel können sich durch Muskelzuckungen, Kribbeln in Armen oder Beinen oder Übelkeit äußern [20].
Eine Gewebsazidose hemmt zudem die Insulin-Ausschüttung aus den Betazellen der Bauchspeicheldrüse und stört die Bindung von Insulin an seine Rezeptoren. Die hieraus resultierende Insulinsresistenz ist ein Risikofaktor für die Entwicklung von Diabetes Mellitus Typ 2 [12].
Extra- und intrazelluläre pH-Störungen begünstigen die Mutation und Proliferation von Krebszellen. Durch metabolische Umprogrammierung werden entartete Zellen säureresistent, was zu einem aggressiven Wachstum führt. Im Tumorgewebe werden meist pH-Werte ≤ 6,6 gemessen [21,22,23].
Gefördert wird das Krebswachstum durch die Hemmung der gegen Tumorzellen gerichteten zytotoxischen T-Zellen. In Studien wurde die T-Zell-vermittelte, spezifische Immunantwort, zu der auch die zytotoxischen T-Zellen gehören, bei einer Gewebsazidose unterdrückt. Dagegen fiel die angeborene Immunantwort abhängig von Zelltyp und Funktion stärker oder schwächer aus [24] (Bild unten).
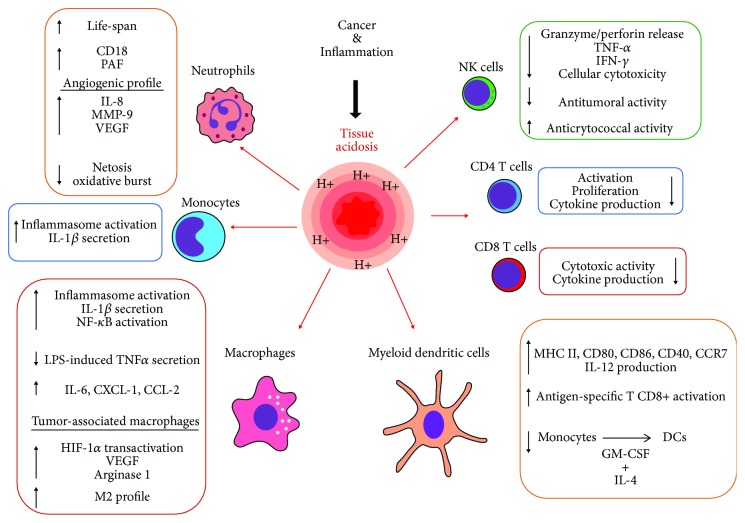
Die T-Zellen des Spezifischen Immunsystems werden in drei Gruppen eingeteilt:
- T-Helferzellen (erkennen Antigene)
- Zytotoxische T-Zellen (bekämpfen Krankheitserreger und Krebszellen)
- Regulatorische T-Zellen (unterdrücken eine überschießende Immunantwort auf harmlose Antigene und körpereigene Strukturen)
Weil auch die Regulatorischen T-Zellen bei niedrigen pH-Werten gehemmt werden, ist die chronische Übersäuerung auch mit dem Verlauf und Schweregrad von Allergien und Autoimmunkrankheiten assoziiert [24].
Warum übersäuern wir?
Bei jungen und gesunden Menschen sind die häufigsten Ursachen für Übersäuerung eine proteinlastige Ernährung, der Verzehr von Fast Food und Fertiggerichten und der Konsum von Softdrinks und Alkohol:
- Tierisches Eiweiß ist reich an Methionin und Cystein, die im Stoffwechsel zu Schwefelsäure oxidiert werden. Fleisch und Eier enthalten viele Phosphoproteine und Phospholipide, die im Körper Säuren bilden.
- Fast Food und Fertiggerichte enthalten Zusatzstoffe wie Nitritpökelsalz, Schwefeldioxid und Phosphate, die die Säurelast erhöhen
- Cola-Getränke enthalten Phosphorsäure. Beim Alkohol-Abbau werden sehr viele basische Mineralstoffe wie Magnesium und Kalzium verbraucht.
Vereinfacht gilt: Je mehr Eiweiß, Sulfat, Phosphat und Chlorid ein Lebensmittel enthält, umso saurer ist es – je mehr Kalium, Magnesium und Kalzium, umso basischer. Basische Lebensmittel wie Obst und Gemüse sind reich an Citrat, Malat und Gluconat, die im Körper als Säurepuffer dienen [3,12].
Ein Risikofaktor für Übersäuerung sind kohlenhydratarme oder ketogene Diäten in Kombination mit Fastenperioden und intensivem anaerobem Training (z. B. Bodybuilding, Gewichtheben). Durch die einseitige Stoffwechsellage entstehen große Mengen an Ketonkörpern und Milchsäure. Dabei kann die Säurelast die renale Ausscheidungskapazität schnell übersteigen [12,13].
Bei älteren oder kranken Menschen trägt eine nachlassende Lungen- oder Nierenfunktion zur Übersäuerung bei. Chronische Erkrankungen wie Asthma, COPD, Diabetes Mellitus oder Lupus Erythematodes sorgen dafür, dass weniger Kohlendioxid abgeatmet bzw. weniger Säuren ausgeschieden werden können. Bewegungsarmut, Steifheit und Muskelverspannungen im Brustbereich schränken die Lungenventilation zusätzlich ein [3,6,8,12].
Bin ich übersäuert?
Die langsame Erschöpfung der körpereigenen Puffersysteme sorgt dafür, dass wir die Übersäuerung lange Zeit nicht bemerken. Warnsignale wie ein erhöhter Cortisolspiegel, Bluthochdruck, hohe Blutzuckerspiegel oder häufige Infekte werden werden meist als natürliche Alterungsprozesse fehlinterpretiert [3,10,12,13,24].
Eine Möglichkeit zur Diagnose der chronischen Azidose sind die Blutgasanalyse und die Urindiagnostik. Die Tabelle unten zeigt die Werte für einen ausgeglichenen Säure-Basen-Haushalt und für eine chronische Azidose [12].
| Messgröße | Optimalwert | Chronische Azidose |
|---|---|---|
| Standard-Bikarbonat (nüchtern) | 27 – 32 mEq/L | < 27 mEq/L |
| Blut-pH-Wert | 7,42 – 7,45 | < 7,42 |
| Kohlendioxid-Partialdruck (pCO2) | < 35 mmHg | 35 – 38 mmHg |
| Ammonium (NH4+) im 24h-Urin | 15 – 40 µg/dL | > 45 µg/dL |
| pH-Wert im Mittelstrahlurin (≥ 4h nach dem Essen) |
∼ 6,8 – 7,5 | < 6,0 |
| Citrat im 24h-Urin | 600 – 800 mg/24h | < 320 mg/24h |
| Kalzium im 24h-Urin | ≈ 16,67 % des oral aufgenommenen Kalziums | > 16,67 % des oral aufgenommenen Kalziums |
Bei Säureüberschuss sinkt der Citrat-Gehalt des Urins. Citrat ist ein wichtiger Bindungspartner für Ca2+. Gemeinsam bilden sie das leicht lösliche Kalziumcitrat, welches problemlos mit dem Harn ausgeschieden werden kann. Fehlt Citrat, bilden sich stattdessen schlecht lösliches Kalziumoxalat und Kalziumphosphat, die sich als Steine in den Nieren und ableitenden Harnwegen festsetzen können. Das Steinrisiko steigt durch die Freisetzung von Ca2+ aus den Knochen.
Maßnahmen zur Entsäuerung
Die einfachste und schnellste Methode zur Entsäuerung ist die Einnahme basischer Nahrungsergänzungmittel*. Diese enthalten Bicarbonate (Natrium-, Magnesium-, Kalziumbicarbonat) oder Citrate (Kalium-, Natrium-, Zinkcitrat).
Wichtig: Bicarbonate sollte man nicht mit dem Essen einnehmen, weil sie die Magensäure (HCl) neutralisieren:
NaHCO3 + HCl ⟶ NaCl + H2O + CO2.
Die Parietalzellen des Magens ersetzen die neutralisierte Säure, indem sie neues HCO3– bilden, das in den Blutpuffer aufgenommen wird. Citrate kann man dagegen mit oder ohne Essen einnehmen. Sie werden erst in der Leber zu Bicarbonat umgewandelt [12].
Vorsicht: Um eine Alkalose zu vermeiden, sollten basische Mittel zurückhaltend dosiert werden. Wer einen hohen Kalium-Spiegel oder Nierenprobleme hat, muss die Einnahme unbedingt mit dem Arzt absprechen!
Am besten ist eine basische Ernährung mit viel Obst, Gemüse und Kräutern. Mineralwasser, Saft und Kräutertee unterstützen die Entsäuerung. Auf Fleisch zu verzichten ist weder notwendig noch sinnvoll, denn tierisches Eiweiß liefert wichtige Nährstoffe für Muskeln, Knochen und Immunsystem. Weil Proteine Glutamin und Ammoniak enthalten, unterstützen sie zudem die renale Säureausscheidung [13,25].

Mit der richtigen Atmung lässt sich die CO2-Ausscheidung optimieren (eine ausreichende Versorgung mit Bicarbonat vorausgesetzt). Traditionelle Verfahren wie Yoga machen sich den gesundheitsfördernden Effekt der Atmung seit Jahrhunderten zunutze. Mann muss aber nicht gleich zum Yogi werden. Leichte Bewegung und bewusstes Atmen an der frischen Luft sind ebenso effektiv.
Weil Säuren auch im Bindegewebe in der Haut gespeichert werden, können sie über die Körperoberfläche ausgeleitet werden. Eine wirksame Methode sind Basenbäder*. Die Wärme öffnet die Hautporen und die Säuren werden im basischen Wasser neutralisiert.
* Als Amazon-Partner verdiene ich an qualifizierten Verkäufen
Quellen
- Oliver Ploss. Moderne Praxis bewährter Regulationstherapien. Herausgeber: Karl. F. Haug Buch*
- Melkonian EA, Schury MP. Biochemistry, Anaerobic Glycolysis. [Updated 2023 Jul 31]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-
- Dr. Alexander Ströhle, Prof. Dr. Thomas Remer. Ernährung und Säure-Basen-Haushalt: Physiologie und Prävention. Ernährung im Fokus 14 (2014) S. 314–324
- Wikipedia – Blutpuffer
- Larsen R. Störungen des Säure-Basen-Haushalts. Anästhesie und Intensivmedizin für die Fachpflege. 2016 Jun 14:822–31. German
- Quade BN, Parker MD, Occhipinti R. The therapeutic importance of acid-base balance. Biochem Pharmacol. 2021 Jan;183:114278
- Wikipeda – Respiratorische Azidose
- Bruno CM, Valenti M. Acid-base disorders in patients with chronic obstructive pulmonary disease: a pathophysiological review. J Biomed Biotechnol. 2012;2012:915150
- Weiner ID, Verlander JW. Role of NH3 and NH4+ transporters in renal acid-base transport. Am J Physiol Renal Physiol. 2011 Jan;300(1):F11-23
- B. Hess (2014). Nephrolithiasis – die Bedeutung des Urin-pH. Der informierte Arzt 10_2014: 21-23.
- Georg Löffler. Basiswissen Biochemie: mit Pathobiochemie. Herausgeber: Springer Buch*
- DiNicolantonio JJ, O’Keefe J. Low-grade metabolic acidosis as a driver of chronic disease: a 21st century public health crisis. Open Heart. 2021 Oct;8(2):e001730
- Vormann, Jürgen & Goedecke, Thomas. (2006). Acid-base homeostasis: Latent acidosis as a cause of chronic diseases. Schweizerische Zeitschrift fur GanzheitsMedizin. 18. 255-266.
- Neville, Anne & Morina, Ardian & Liskiewicz, Tomasz & Yan, Yu. (2007). Synovial joint lubrication - Does nature teach more effective engineering lubrication strategies?. ARCHIVE Proceedings of the Institution of Mechanical Engineers Part C Journal of Mechanical Engineering Science 1989-1996 (vols 203-210)
- Wikipedia – Calcium- und Phosphathaushalt
- Wikipedia – Natrium
- Bushinsky DA, Krieger NS. Effects of acid on bone. Kidney Int. 2022 Jun;101(6):1160-1170
- Peterson AK, Moody M, Nakashima I, Abraham R, Schmidt TA, Rowe D, Deymier A. Effects of acidosis on the structure, composition, and function of adult murine femurs. Acta Biomater. 2021 Feb;121:484-496
- Gupta A, El-Wiher N. Therapeutic Challenges in Management of Severe Acidosis and Profound Hypokalemia in Pediatric Diabetic Ketoacidosis. Glob Pediatr Health. 2019 Apr 8
- Doccheck – Hyperkaliämie
- Gründer, Stefan & Vanek, Jakob & Pissas, Karolos-Philippos. (2024). Acid-sensing ion channels and downstream signalling in cancer cells: is there a mechanistic link?. Pflügers Archiv - European Journal of Physiology. 1-14
- Swietach P, Boedtkjer E, Pedersen SF. How protons pave the way to aggressive cancers. Nat Rev Cancer. 2023 Dec;23(12):825-841
- Rolver MG, Holland LKK, Ponniah M, Prasad NS, Yao J, Schnipper J, Kramer S, Elingaard-Larsen L, Pedraz-Cuesta E, Liu B, Pardo LA, Maeda K, Sandelin A, Pedersen SF. Chronic acidosis rewires cancer cell metabolism through PPARα signaling. Int J Cancer. 2023 Apr 15;152(8):1668-1684
- Erra Díaz F, Dantas E, Geffner J. Unravelling the Interplay between Extracellular Acidosis and Immune Cells. Mediators Inflamm. 2018 Dec 30;2018:1218297
- Remer T. Influence of nutrition on acid-base balance–metabolic aspects. Eur J Nutr. 2001 Oct;40(5):214-20








Comments powered by Talkyard.