Teilen auf
Twitter Facebook LinkedIn WhatsAppBeim zellulären Energiestoffwechsel denken einige vielleicht mit Schaudern an den Biounterricht in der Schule zurück. Auswendiglernen von Zellgedöns, nur um es nach der Prüfung wieder zu vergessen… Das Wissen über Mitochondrien braucht man eh nie wieder. Davon war ich überzeugt.
Heute weiß ich, dass ich falsch lag. Denn die Mitochondrien produzieren die Energie, die unserem Gehirn das Denken ermöglichen, unsere Organe am Laufen halten und unsere Muskeln und Haare wachsen lassen. Lässt Ihre Funktion nach, geht es mit der Lebensqualität bergab: Dauermüdigkeit, ständiges Frieren und Konzentrationsschwäche sind nur einige Symptome [1*].
Um zu verstehen, wie der Zellstoffwechsel unsere Gesundheit beeinflusst und warum Vitamine und Mineralstoffe uns zu mehr Lebensenergie verhelfen, solltest Du ein paar Grundlagen kennen. Wenn Dich die biochemischen Details nicht interessieren, kannst Du direkt zur Rolle der Nährstoffe springen.
Die Mitochondrien
Mitochondrien gehören zu den Zellorganen (Organellen), die im Zellkern fast aller menschlichen, tierischen und pflanzlichen Zellen enthalten sind. Je größer der Energiebedarf einer Zelle ist, desto mehr Mitochondrien hat sie. Im Durchschnitt befinden sich in einer menschlichen Zelle zwischen 1.000 und 2.000 Mitochondrien, die meist tubusartig miteinander vernetzt sind. In reifen Eizellen kann die Zahl der Mitochondrien sogar bei mehreren Hunderttausenden liegen [2]. Mitochondrien sind in der Lage, zu wachsen und sich durch Zellteilung zu vermehren. Ein auslösender Reiz ist zum Beispiel Kraftsport. Er bewirkt, dass sich die Mitochondrien in den Muskelzellen vermehren.
Die Abbildung oben zeigt den schematischen Aufbau eines Mitochondriums. Es besteht aus einer glatten, doppelwandigen Außenmebran und einer stark gefalteten Innenmembran. Der von der Innenmembran umschlossene Bereich wird als Matrix bezeichnet. In diesem läuft der Citratzyklus ab, den wir weiter unten noch kennenlernen. Die mitochondrialen Membranen besitzen Transportkanäle, die den Stoffaustausch zwischen der Matrix, dem Membranzwischenraum und dem Zytosol (Zellflüssigkeit außerhalb des Mitochondriums) ermöglichen.
Der Zellstoffwechsel
Pro Sekunde finden in einer gesunden Zelle etwa eine Milliarde chemische Reaktionen statt [3]. Wir unterscheiden zwei Arten von Stoffwechselprozessen:
-
Anabolismus: Die Bereitstellung von Bausteinen für die Biosynthese körpereigener Proteine, Zellstrukturen und Botenstoffe
-
Katabolismus: Der Abbau von Nahrungsstoffen für energieliefernde Reaktionen unter Bildung von Kohlendioxid (CO2) und Wasser (H2O)
Einen Teil der vom katabolen Stoffwechsel erzeugten Energie konserviert die Zelle in energiereichen Molekülen wie Pyruvat, Acetyl-Coenzym A (Acetyl-CoA) oder Adenosintriphosphat (ATP). Der anabole Stoffwechsel nutzt diese, um aus einfachen Molekülbausteinen die komplexeren, körpereigenen Makromoleküle zusammenzubauen. Katabolismus und Anabolismus sind also eng miteinander verbunden, sie können jedoch nicht gleichzeitig ablaufen [4].
Redoxreaktionen
Nahezu alle chemischen Reaktionen im Zellstoffwechsel sind Redoxreaktionen. Redox steht für Reduktion-Oxidation und bedeutet, dass ein Reaktionspartner dem anderen Elektronen entzieht. Der Reaktionspartner, der die Elektronen aufnimmt, wird reduziert und der abgebende oxidiert. Weil es in der Biochemie (anders als in der Chemie) keine freien Elektronen gibt, werden im Zellstoffwechsel Wasserstoffatome anstatt Elektronen übertragen.
Das Wasserstoffatom H besteht aus einem Atomkern H+ und einem Elektron e-. Weil das Elektron nur sehr locker an das Wasserstoffatom gebunden ist, wird es in einer chemischen Verbindung zum Reaktionspartner hingezogen. Wasserstoff ist also ein Reduktionsmittel. Umgekehrt führt die Abgabe eines Wasserstoffatoms zur Oxidation eines Stoffs.
| Reduktion | Elektronenaufnahme: | + e- | ≙ | Aufnahme von Wasserstoff: | + H+ + e- |
| Oxidation | Elektronenabgabe: | - e- | ≙ | Abgabe von H-Atomen: | - H+ - e- |
Ein starkes Oxidationsmittel ist das Sauerstoffatom O. Weil es Elektronen wortwörtlich an sich “reißt”, wird jedes Element, das mit Sauerstoff eine Verbindung eingeht, oxidiert. Dabei wird Energie freigesetzt.
Die wichtigste katabole Redoxreaktion
Die Triebfeder des katabolen Zellstoffwechsels ist die Oxidation des Einfachzuckers Glukose mit Sauerstoff. Aus dieser gewinnt der Körper eine Energie von ca. 16 Kilojoule pro Gramm Glukose. Die Reaktionsgleichung lautet:
C6H12O6 + 6 O2 ⟶ 6 CO2 + 6 H2O.
Die Katalysatoren dieser Reaktion sind die Coenzyme. Sie sorgen dafür, dass die Oxidation mit Sauerstoff nicht schlagartig abläuft, sondern in kontrollierten Schritten, zu denen auch die Reaktionen des Citratzyklus und der Atmungskette gehören. Liefe die Oxidation in einem einzigen Schritt ab, käme die Energiefreisetzung einer Explosion gleich, die die Zelle zerstören würde.
Coenzyme
Coenzyme sind Elektronentransporter, die organischen Verbindungen Wasserstoffatome entziehen und sie an anderer Stelle wieder abgeben. Sie dienen also als Oxidations- und Reduktionsmittel. Die bei der Oxidation von Coenzymen freigesetzte Energie fließt unter anderem in die Synthese von ATP.
Die meisten Coenzyme sind Vitamine oder Vitaminderivate. Sie müssen dem Körper von außen zugeführt und in ihre biologisch aktive Form umgewandelt werden. Zu den Redox-Coenzymen gehören zum Beispiel Cobalamin (Vitamin B12), Folat (Folsäure) oder Ubichinon (Coenzym Q) [5].
Die Coenzyme FAD und NAD
Die wichtigste energieliefernde Reaktion im Zellstoffwechsel ist die Reoxidation der Coenzyme Nicotinamid-Adenin-Dinukleotid (NAD) und Flavin-Adenin-Dinukleotid (FAD) in der inneren Mitochondrienmembran. NAD+ ist die biologisch aktive Form der Nikotinsäure (Vitamin B3) und FAD ist ein Derivat des Riboflavins (Vitamin B2). Sie werden durch die Aufnahme von 2 e- reduziert.
| NAD oxidiert | NAD+ + 2H+ + 2 e- | ⇌ | NADH + H+ | NAD reduziert |
| FAD oxidiert | FAD + 2H+ + 2 e- | ⇌ | FADH2 | FAD reduziert |
Durch die Aufnahme der Wasserstoffatome ändert sich die chemische Struktur der Coenzyme. Die untenstehende Abbildung zeigt dies am Beispiel von FAD.
NAD+ und FAD nehmen Elektronen im Citratzyklus auf und geben sie in der Atmungskette wieder ab. Die Elektronen werden zur Synthese von ATP genutzt.
Zellatmung
Als Zellatmung bezeichnet man den Energiegewinn der Zelle durch die Oxidation organischer Stoffe mit Sauerstoff. Verschiedene Redoxreaktionen in katabolen Stoffwechselwegen setzen diese Energie frei und speichern sie in den energiereichen Phosphatbindungen des körpereigenen Energiespeichermoleküls ATP. Den Ablauf der Zellatmung zeigt die untenstehende Abbildung [6].
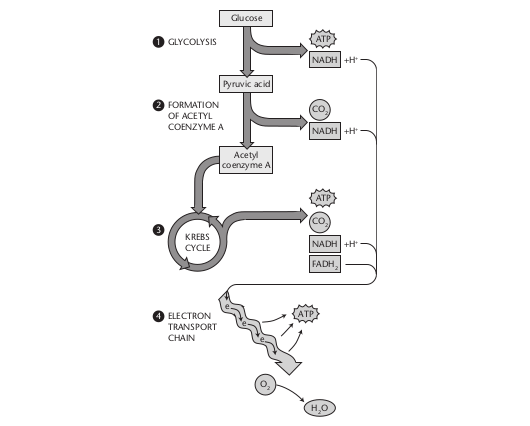
Die Zellatmung umfasst fünf Teilprozesse:
- Glykolyse: Die bevorzugte Energiequelle für die Produktion von ATP ist Glukose. Glukose wird im Zytosol zunächst zu Pyruvat abgebaut.
- Umwandlung in Acetyl-Coenzym A: Pyruvat wird in die mitochondriale Matrix aufgenommen und enzymatisch zu Acetyl-Coenzym A abgebaut.
- Citratzyklus: Der Citratzyklus (Krebs-Zyklus) reduziert die Coenzyme NAD+ und FAD.
- Atmungskette: In der Atmungskette (Elektronentransportkette) werden NADH und FADH2 mit Energiegewinn wieder re-oxidiert.
- ATP-Produktion: Durch oxidative Phospholierung wird ATP gebildet.
Acetyl-Coenzym A
Das Stoffwechselzwischenprodukt Acetyl-CoA bildet die Brücke zwischen der Glykolyse und dem Citratzyklus. Bei Bedarf kann Acetyl-CoA auch durch die Oxidation von Fettsäuren (β-Oxidation) oder den Abbau der ketogenen Aminosäuren Leucin, Isoleucin, Lysin, Phenylalanin, Tyrosin und Tryptophan [7] metabolisiert werden. Fettsäuren und Aminosäuren werden – anders als Glukose – in der mitochondriellen Matrix abgebaut.
Citratzyklus
Kohlenhydate, Fettsäuren und ketogene Aminosäuren werden nach ihrem Umbau in Acetyl-CoA in den Citratzyklus geschleust. Nicht-ketogene (Glucogene) Aminosäuren können nicht zu Acetyl-CoA abgebaut werden. Sie fließen als α-Ketoglutarat, Succinyl-CoA oder Fumarat in den Citratzyklus ein [7].
Der Citratzyklus ist der zentrale Dreh- und Angelpunkt des Zellstoffwechsels, weil er eine Vielzahl von Stoffwechselwegen miteinander verknüpft. Er besteht aus acht zyklisch miteinander verbundenen Reaktionsschritten. Nach Bedarf wechselt er vom Katabolismus in den Anabolismus und zurück.
Kataboler Stoffwechsel (Zellatmung):
Der Citratzyklus oxidiert Acetyl-CoA in acht Schritten zu H2O und CO2. Mit den dabei gewonnenen H-Atomen reduziert er die Coenzyme NAD+ und FAD, die anschließend in der Atmungskette reoxidiert werden. Aus einem Acetyl-CoA enstehen so acht H-Atome in Form von drei NADH/H+ und einem FADH2. Außerdem wird das Energiespeichermolekül GTP gebildet (Abbildung unten).
Wann immer der Körper Energie benötigt – bei körperlicher Anstrengung oder in Stresssituationen – läuft der katabole Stoffwechsel auf Hochtouren.
Anaboler Stoffwechsel
Im anabolen Zustand liefert der Citratzyklus die Bausteine für die Regeneration und den Aufbau der körpereigenen Substanz. Zum Anabolismus gehören die Synthese körpereigener Fett- und Aminosäuren, die Gluconeogenese, die Glykogenbildung und die Produktion des roten Blutfarbstoffs (Häm). Der anabole Stoffwechselweg wird in Ruhephasen und während des Schlafs aktiviert.
Reaktionsprodukte des Citratzyklus
Die untenstehende Abbildung zeigt die acht Reaktionsschritte des Citratzyklus mit seinen Intermediaten. Bei einer katabolen Stoffwechsellage laufen die Reaktionen reihum durch und es kommt zur Reduktion der Coenzyme NAD+ und FAD und zur Bildung eines GTP aus GDP.
Der anabole Stoffwechsel entzieht dem Citratzyklus dagegen einen Teil seiner Zwischenprodukte, um sie dem Aufbau körpereigener Strukturen zuzuführen. Damit der Citratzyklus nicht zum Erliegen kommt, werden ihm von außen neue kohlenstoffhaltige Verbindungen zugefügt (anaplerotische Reaktionen).
Die Substrate des Citratzyklus, die für ihre Bildung benötigten Cofaktoren und ihr Verwendungszweck sind in der untenstehenden Tabelle zusammengefasst.
| Schritt | Reaktionsprodukt | Cofaktoren für Bildung | Verwendungszweck |
|---|---|---|---|
| 1 | Citrat | - Fettsäurebiosynthese im Zytosol | |
| 2 | Isocitrat | Eisen [8] | |
| 3 | α-Ketoglutarat | NAD, Mangan/Magnesium [10] | - Synthese der Aminosäuren Glutamat und Aspartat - Stickstoffregulator (bindet Stickstoff) - Radikalfänger |
| 4 | Succinyl-CoA | Vitamin B1 (Thiamin), Vitamin B2 (Riboflavin), α-Liponsäure, Coenzym A, NAD, Magnesium [1*] |
- Ausgangsstoff der Häm-Biosynthese |
| 5 | Succinat | GTP | |
| 6 | Fumarat | ||
| 7 | Malat | ||
| 8 | Oxalacetat | - Ausgangsstoff der Gluconeogenese - Synthese der Aminosäure Aspartat |
|
| NADH/H+ | NAD aus Vitamin B3 oder Tryptophan [9] |
- Atmungskette | |
| FADH2 | FAD aus Vitamin B2 und ADP | - Atmungskette | |
| GTP | Guanosindiphosphat (GDP) | - Energiespeicher |
Die Coenzyme NADH/H+ und FADH2 werden bei der Zellatmung nicht verbraucht, sondern nach ihrer Re-Oxidation in der Atmungskette als NAD+ und FAD an den Citratzyklus zurückgegeben. Weil NAD und FAD jedoch bei anderen Stoffwechselprozessen verbraucht werden, muss der Körper sie bedarfsabhängig neu synthetisieren.
Atmungskette
In der Atmungskette wird das NADH/H+ aus dem Glukoseabbau und dem Citratzyklus mit Sauerstoff unter Energiegewinn re-oxidiert:
NADH/H+ + 1/2 O2 ⟶ NAD+ + H2O
Diese Reaktion läuft in vier Schritten ab, die von einer Vielzahl unterschiedlicher Enzyme katalisiert werden. Man bezeichnet sie als Multienzymkomplexe I - IV.
In jedem Reaktionsschritt werden Elektronen von einem Substrat auf ein anderes übertragen. Deshalb wird die Atmungskette auch als Elektronentransportkette bezeichnet. Die hierbei freiwerdende Energie dient der Verschiebung von Protonen (H+) aus der Matrix in den Membranzwischenraum.
Allerdings agieren nur die Enzymkomplexe I, III und IV als Protonenpumpen. Komplex II ist Elektronenlieferant für Komplex III. Die Elektronen liefert das Coenzym FADH2, das dabei zu FAD oxidiert wird:
FADH2 ⟶ FAD + 2H+ + 2 e-
Die vier Enzymkomplexe benötigen unterschiedliche Cofaktoren. Diese sind in der Tabelle unten aufgelistet [1*,11*].
| Enzymkomplex | Elektronentransport | Protonentransport | Cofaktoren |
|---|---|---|---|
| Komplex I | 2 e- | 4 H+ | Vitamin B2, Eisen, Ubichinon |
| Komplex II | 2 e- | - | Vitamin B2, Eisen, Ubichinon |
| Komplex III | 4 e- | 4 H+ | Eisen, Ubichinon/Ubichinol, Häm |
| Komplex IV | 4 e- | 2 H+ | Kupfer, Häm |
Das Bild rechts zeigt den Enzymkomplex I: Zwei Elektronen (e-) wandern von NADH über eine Kette aus Eisen-Schwefel-Zentren in das Innere der Mitochondrienmembran, wo sie von Ubichinon (Q) aufgenommen werden. Ubichinon wird durch die Reduktion zu Ubichinol (QH2). Die dabei freiwerdende Energie transportiert vier Protonen (H+) aus der Matrix in den Intermembranraum.
Pro oxidiertem NADH werden insgesamt zehn Protonen über die Mitochondrienmembran gepumpt, wodurch eine elektrochemische Potentialdifferenz zwischen der Matrix und dem Zwischenmembranraum entsteht. Diese Potentialdifferenz ist wichtig für die ATP-Bildung im nächsten Schritt.
ATP-Gewinn durch Oxidative Phospholierung
Am Ende der Atmungskette steht ein biochemischer Prozess, der als oxidative Phospholierung bezeichnet wird. Dabei wird der zuvor in der Atmungskette aufgebaute Protonengradient über der Mitochondrienmembran mithilfe des Enzyms ATP-Synthase wieder abgebaut.
Mit der freiwerdenden Energie bildet die ATP-Synthase das Speichermolekül ATP, indem es ein Phosphat-Atom auf ADP überträgt (Abbildung rechts):
ADP + P ⟶ ATP + H2O
Die ATP-Synthase benötigt mindestens drei H+ für die Synthese eines ATP sowie ein zusätzliches H+ für den Transport eines P-Atoms in die Matrix [11*]. Als Nebenprodukt der ATP-Bildung entsteht Wasser .
Energiebilanz
Schauen wir uns nachfolgend die Energiebilanz der Zellatmung an:
| Nr. | Teilprozess | Beschreibung | Energie-ausbeute | Coenzym- ausbeute |
|---|---|---|---|---|
| 1 | Glykolyse | Aus einem Molekül Glukose entstehen zwei Moleküle Pyruvat | 2 ATP | |
| 2 | Oxidative Decarboxylierung | Aus zwei Molekülen Pyruvat entehen zwei Moleküle Acetyl-CoA | - | |
| 3 | Citratzyklus | Der Citratzyklus wird zweimal durchlaufen. | 2 GTP | |
| 4 | Atmungskette | Die 10 NADH und 2 FADH2 aus Schritt 1 bis 3 werden unter Bildung eines Protonengradienten re-oxidiert | - | 10 NAD+ 2 FAD |
| 5 | Oxidative Phospholierung | Der Protonengradient wird unter ATP-Bildung abgebaut | - |
Für jedes Elektronenpaar, das von NADH zur Atmungskette transportiert wird, werden ca. 2,5 ATP erzeugt, beim Transport durch FADH2 ca. 1,5 ATP [12].
Ausnahme sind die beiden NADH aus Schritt 1: Sie müssen erst vom Zytosol in die Mitochondrienmatrix transportiert werden. Dabei kann es zu einem Energieverlust kommen. Infolgedessen werden aus diesen NADH jeweils 1,5 bis 2,5 ATP erzeugt. Weil GTP und ATP aus energetischer Sicht gleichwertig sind, enstehen bei der Zellatmung in Summe also 30 bis 32 ATP [12].
Werden Fettsäuren statt Glukose oxidiert, wächst die ATP-Ausbeute mit der Länge der Fettsäure. So gewinnt eine Zelle bei der vollständigen β-Oxidation der langkettigen Palmitinsäure (16 C-Atome) bis zu 106 Moleküle ATP [13].
Die Rolle der Mikronährstoffe
Nehmen wir dauerhaft zu wenige Vitamine, Mineralien und Spurenelemente auf, produzieren unsere Mitochondrien mit der Zeit immer weniger Energie. Denn der Zellstoffwechsel ist von einer großen Zahl Enzyme abhängig, die für ihre Funktion Nährstoffe als Cofaktoren benötigen. Der durch Nährstoffdefizite erworbene Energiemangel wird als sekundäre Mitochondriopathie bezeichnet.
Die nachfolgende Tabelle gibt einen Überblick über die Rolle ausgewählter Nährstoffe im zellulären Energiestoffwechsel [6,14*,15].
| Nährstoff | Funktion im zellulären Energiestoffwechsel |
|---|---|
| Vitamine | |
| Thiamin (B1) | - Cofaktor bei der Umwandlung von Pyruvat in Acetyl-CoA (Kohlenhydratabbau) - Notwendig für die Muskelfunktion einschließlich des Herzmuskels - Beteiligt an oxidativen Carboxylierungsreaktionen, die ebenfalls Mangan benötigen |
| Riboflavin (B2) | - Bestandteil der Coenzyme FAD und FMN - Cofaktor in der mitochondrialen Atmungskette (Komplex I und II) |
| Niacin (B3) | - Vorstufe der Coenzyme NAD und NADP, die eine Schlüsselrolle bei fast allen Redoxreaktionen des Zellstoffwechsel spielen |
| Pyridoxin (B6) | - Cofaktor bei über 100 enzymatischen Reaktionen (Protein- und Aminosäuren-Stoffwechsel) - Notwendig für die Umwandlung von Tryptophan in Niacin - Cofaktor des Glykogenabbaus und der Gluconeogenese |
| Folsäure | - Vorstufe des Coenzyms THF, das für Methylierungsprozesse benötigt wird - Bestandteil von Coenzymen für das Zellwachstum - Etwa 30 - 50 % der zellulären Folate (aktivierte Folsäure) befinden sich in den Mitochondrien. |
| Vitamin B12 | - Cofaktor im Citrat-Zyklus (Fett- und Aminosäurestoffwechsel) - Notwendig für die Umwandlung von Folsäure in Folat |
| Biotin | - Cofaktor im Kohlenhydrat-, Fett- und Aminosäurestoffwechsel - Cofaktor der Gluconeogenese - Notwendig für die Verwertung anderer B-Vitamine |
| Pantothensäure | - Bestandteil von Coenzym A und damit essentiell für den Citratzyklus - Beteiligt am Kohlenhydrat- und Fettstoffwechsel |
| Vitamin C | - Notwendig für die β-Oxidation langkettiger Fettsäuren (Carnitin-Synthese) - Fördert die Eisenaufnahme - Starkes Antioxidans |
| Mineralien | |
| Kalzium | - Aktivator der β-Oxidation - Mitochondrialer Träger für ATP (zusammen mit Magnesium) - Wesentlich für die Erregbarkeit von Muskeln und Nerven |
| Magnesium | - Cofaktor bei über 300 Enzymreaktionen - Beteiligt an allen ATP-abhängigen Enzymreaktionen - Mitochondrialer Träger für ATP (zusammen mit Kalzium) - Wesentlich für die Erregbarkeit von Muskeln und Nerven |
| Phosphor | - Bestandteil der Coenzyme NAD, NADP, FAD und Coenzym A - Bestandteil der Energiespeichermoleküle ATP und Kreatinphosphat |
| Spurenenlemente | |
| Kupfer | - Cofaktor der mitochondrialen Atmungskette (Komplex IV) - Beteiligt am Eisenstoffwechsel |
| Chrom | - Potenziert die Insulinwirkung und fördert so die Glukoseaufnahme in die Zellen - Notwendig für den Proteinstoffwechsel des Herzgewebes |
| Eisen | - Cofaktor der mitochondrialen Atmungskette (Komplex I, II und III) - Wesentlich für den Transport (Hämoglobin) und die Speicherung (Myoglobin) von Sauerstoff |
| Mangan | - Cofaktor im Kohlenhydratstoffwechsel und bei der Gluconeogenese - Bestandteil des Enzyms Mangan-Superoxiddismutase, das die Mitochondrien gegen freie Radikale schützt |
| Zink | - Wesentlicher Bestandteil von mehr als 200 Enzymen, von denen einige am Energiestoffwechsel beteiligt sind |
Nährstoffdefizite
Nährstoffdefizite entstehen, wenn die Absorption im Magen-Darm-Trakt gestört ist (z.B. bei Magensäuremangel oder chronisch-entzündlichen Darmerkrankungen) oder bei Stoffwechselstörungen, die zu einer erhöhten Ausscheidung einzelner Nährstoffe führen (z.B. Pyrrolurie). Nicht selten sind sie auch die Folge einer vitalstoffarmen Ernährung mit Fertiggerichten und Fast Food. Auch Alkohol- und Zigarettenkonsum führen dazu, dass der Körper stärker entgiften muss und dadurch mehr Nährstoffe verbraucht.
Mangelzustände entwickeln sich meist schleichend und fallen lange Zeit nicht auf. Erst im fortgeschrittenen Stadium zeigen sich unspezifische Symptome wie Müdigkeit, Erschöpfung, Frieren oder Schlaflosigkeit. Wenn ein Teil der zellulären Stoffwechselwege blockiert ist, kommt es zu schweren Stoffwechselstörungen und letztendlich zu irreversiblen Gewebeschäden [1*,6,11*,14*].
Nahrungsergänzungsmittel
Um einem Nährstoffmangel vorzubeugen, kann die Einnahme hochwertiger Nahrungsergänzungsmittel (NEM) sinnvoll sein. Dabei gilt: Qualität kostet. Wenn Du Deine Versorgung mit Mikronährstoffen vorher beim Arzt messen lassen möchtest, muss Du die Leistung allerdings privat bezahlen.
Der Tenor der Mainstream-Medien lautet, dass NEM sinnlos bis gefährlich sind, da wir in Deutschland angeblich genügend Nährstoffe mit der Nahrung zu uns nehmen. Eine lesenswerte Replik auf diese Behauptungen hat Chris Michalk von Genetisches Maximum geschrieben. Informationen zur Vitaminversorgung in Deutschland findest Du außerdem hier im letzten Abschnitt.
Mitochondrienmedizin
Für die Mitochondrienmedizin sind Störungen der mitochondrialen Stoffwechselwege eine wichtige Ursache für Krankheiten wie CFS, Depression, Autoimmunkrankheiten oder Krebs. Ihr Therapieansatz besteht darin, Nährstoffdefizite über die Messung des Vitamin- und Mineralstoffgehalts in Blut und Geweben sowie über Metabolite im Urin zu bestimmen und mit NEM und/oder Infusionen gezielt zu behandeln [1*].
Weil sich ihr Therapieansatz fundamental von der klassischen Schulmedizin unterscheidet, wird die Mitochondrienmedizin von vielen Ärzten als unseriös kritisiert [16]. Wenn wir von der Medizin allerdings mehr erwarten als die medikamentöse Unterdrückung von Krankheitssymptomen (meist ohne Aussicht auf Heilung), wird die Mitochondrienmedizin die Medizin der Zukunft sein.
* Als Amazon-Partner verdiene ich an qualifizierten Verkäufen
Quellen
- Dr. sc. med. Kuklinski J. Mitochondrien: Symptome, Diagnose und Therapie, Herausgeber: Aurum in Kamphausen Media GmbH. Auflage: 3 (2018) Buch*
- Wikipedia – Mitochondrium
- https://www.bio-filia.de/2018/03/14/am-anfang-war-die-zelle/
- Wikipedia – Katabolismus
- Wikipedia – Cofaktor (Biochemie)
- Huskisson E, Maggini S, Ruf M. The role of vitamins and minerals in energy metabolism and well-being. J Int Med Res. 2007 May-Jun;35(3):277-89.
- Wikipedia – Amionsäurenstoffwechsel
- Wikipedia – Aconitase
- http://www.vitalstoff-lexikon.de/Vitamin-B-Komplex/Niacin-Vitamin-B3-/
- http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/5/bc/vlus/chemical_pathways/citronensaeurezyklus.vlu/Page/vsc/de/ch/5/bc/chemical_pathways/citronensaeurezyklus/isocitrat_dehydrogenase/isocitrat_dehydrogenase.vscml.html
- Georg Löffler. Basiswissen Biochemie: mit Pathobiochemie. Herausgeber: Springer Buch*
- Wikipedia – Zellatmung
- Wikipedia – β-Oxidation
- Burgerstein U. , Schurgast H., Zimmermann M.: Handbuch Nährstoffe: Vorbeugen und heilen durch ausgewogene Ernährung: Alles über Vitamine, Mineralstoffe und Spurenelemente, Herausgeber : TRIAS; 13. Edition (21. Februar 2018) Buch*
- https://www.amboss.com/de/wissen/Vitamine
- https://www.spiegel.de/spiegel/mitochondrien-quacksalber-missbrauchen-die-serioese-forschung-a-1167104.html








Comments powered by Talkyard.